河北省唐山市遵化市2021-2022学年高一上学期期中考试化学试题
试卷更新日期:2022-07-01 类型:期中考试
一、单选题
-
1. “云蒸霞蔚”出自《世说新语·寓言》,表示霞光透过云层的绚丽灿烂。“云”从化学角度分析属于下列分散系中的( )A、溶液 B、悬浊液 C、乳浊液 D、胶体2. 运输化学药品浓硫酸的车辆,应该张贴的标志为( )A、
 B、
B、 C、
C、 D、
D、 3. 世界卫生组织(WHO)将ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。ClO2属于( )A、氧化物 B、碱 C、酸 D、盐4. 分类是学习和研究化学的一种重要方法。下列分类合理的是( )A、K2CO3和K2O都属于盐 B、KOH和Na2CO3都属于碱 C、H2SO4和HNO3都属于酸 D、CO2和CO都属于酸性氧化物5. 下列各组物质,按化合物、单质、混合物的顺序排列的是( )A、烧碱、液态氧、干冰 B、生石灰、白磷、加碘盐 C、盐酸、铁、氯化氢 D、空气、氮气、胆矾6. 适度饮水有益于健康,但过量饮水会使体内电解质浓度过低,导致生理紊乱而引起“水中毒”。下列属于人体内常见的电解质的是( )A、CO2 B、NaCl C、O2 D、乙醇7. 胶体的本质特征是( )A、丁达尔现象 B、微粒带电 C、吸附性 D、粒子直径为1~100 nm8. 下列仪器中,通常不能用作反应容器的是( )
3. 世界卫生组织(WHO)将ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。ClO2属于( )A、氧化物 B、碱 C、酸 D、盐4. 分类是学习和研究化学的一种重要方法。下列分类合理的是( )A、K2CO3和K2O都属于盐 B、KOH和Na2CO3都属于碱 C、H2SO4和HNO3都属于酸 D、CO2和CO都属于酸性氧化物5. 下列各组物质,按化合物、单质、混合物的顺序排列的是( )A、烧碱、液态氧、干冰 B、生石灰、白磷、加碘盐 C、盐酸、铁、氯化氢 D、空气、氮气、胆矾6. 适度饮水有益于健康,但过量饮水会使体内电解质浓度过低,导致生理紊乱而引起“水中毒”。下列属于人体内常见的电解质的是( )A、CO2 B、NaCl C、O2 D、乙醇7. 胶体的本质特征是( )A、丁达尔现象 B、微粒带电 C、吸附性 D、粒子直径为1~100 nm8. 下列仪器中,通常不能用作反应容器的是( )①容量瓶 ②烧杯 ③锥形瓶 ④量筒
A、①②④ B、②③ C、①④ D、③④9. 下列离子中,所带电荷数与该离子的核外电子层数相等的是( )A、Mg2+ B、Na+ C、Al3+ D、K+10. 下列叙述中正确的是( )A、 和是中子数不同质子数相同的同种核素 B、中子数为20的氯原子可以表示为 C、同种元素的原子均有相同的质子数和中子数 D、F-的结构示意图可以表示为 11. 下列实验方案中,设计正确的是( )A、用乙醇萃取碘水中的碘单质 B、用焰色反应鉴别NaCl和Na2SO4 C、用蒸馏的方法分离植物油和水的混合物 D、用NaOH溶液和红色石蕊试纸检验溶液中是否存在NH12. 分类方法在化学学科发展中起到了非常重要的作用。下列分类标准合理的是( )A、根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 B、根据与氧结合的元素是金属还是非金属,把氧化物分为酸性氧化物和碱性氧化物 C、据物质所含元素的种类把物质分为纯净物和混合物 D、根据反应中是否有化合价变化将化学反应分为氧化还原反应和非氧化还原反应13. 物质的量是表示含有一定数目微粒集合体的物理量。下列说法错误的是( )A、常温下1molN2的质量为28g B、1mol某种微粒集合体含微粒数目约为6.02×1023 C、化学反应中各物质的质量之比等于它们的物质的量之比 D、该物理量不能用于描述宏观物质形成的集合体14. 下列说法正确的是( )A、气体摩尔体积就是22.4L B、任何状况下,1mol任何气体的体积一定是22.4L C、标准状况下22.4L水含有6.02×1023个分子 D、1molH2和O2的混合气体在标准状况下的体积约22.4L15. 同温同压下两个容积相等的储气瓶,一个装有CO2 , 另一个装有CO,两储气瓶中的下列物理量不相同的是( )A、密度 B、物质的量 C、分子数 D、碳原子数16. 氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应中属于阴影部分的是 ( )
11. 下列实验方案中,设计正确的是( )A、用乙醇萃取碘水中的碘单质 B、用焰色反应鉴别NaCl和Na2SO4 C、用蒸馏的方法分离植物油和水的混合物 D、用NaOH溶液和红色石蕊试纸检验溶液中是否存在NH12. 分类方法在化学学科发展中起到了非常重要的作用。下列分类标准合理的是( )A、根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 B、根据与氧结合的元素是金属还是非金属,把氧化物分为酸性氧化物和碱性氧化物 C、据物质所含元素的种类把物质分为纯净物和混合物 D、根据反应中是否有化合价变化将化学反应分为氧化还原反应和非氧化还原反应13. 物质的量是表示含有一定数目微粒集合体的物理量。下列说法错误的是( )A、常温下1molN2的质量为28g B、1mol某种微粒集合体含微粒数目约为6.02×1023 C、化学反应中各物质的质量之比等于它们的物质的量之比 D、该物理量不能用于描述宏观物质形成的集合体14. 下列说法正确的是( )A、气体摩尔体积就是22.4L B、任何状况下,1mol任何气体的体积一定是22.4L C、标准状况下22.4L水含有6.02×1023个分子 D、1molH2和O2的混合气体在标准状况下的体积约22.4L15. 同温同压下两个容积相等的储气瓶,一个装有CO2 , 另一个装有CO,两储气瓶中的下列物理量不相同的是( )A、密度 B、物质的量 C、分子数 D、碳原子数16. 氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应中属于阴影部分的是 ( ) A、4NH3 +5O2=4NO+6H2O B、4Fe(OH)2+O2+2H2O=4Fe(OH)3 C、2NaHCO3=Na2CO3+H2O+CO2↑ D、Cl2+2NaBr=2NaCl +Br217. 下列有关实验操作中,正确的是( )A、pH试纸在使用前先用蒸馏水润湿 B、用pH试纸测得某溶液的pH为3 C、用500 mL容量瓶量取480 mL溶液 D、用50 mL量筒量取18.42 mL稀硫酸18. 在反应2Na2O2+2CO2=2Na2CO3+O2中,Na2O2是( )A、氧化剂 B、还原剂 C、既是氧化剂又是还原剂 D、既不是氧化剂也不是还原剂19. 下列除去杂质的方法中,正确的是( )A、除去N2中少量O2:通过灼热的炭层,收集气体 B、除去KCl溶液中少量的MgCl2:加入适量NaOH溶液,过滤 C、除去FeSO4溶液中少量的CuSO4:加入足量铁屑,充分反应后过滤 D、除去CO2中少量的HCl:将气体通入足量的NaOH溶液,收集气体20. 用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作.下列图示对应的操作规范的是( )A、
A、4NH3 +5O2=4NO+6H2O B、4Fe(OH)2+O2+2H2O=4Fe(OH)3 C、2NaHCO3=Na2CO3+H2O+CO2↑ D、Cl2+2NaBr=2NaCl +Br217. 下列有关实验操作中,正确的是( )A、pH试纸在使用前先用蒸馏水润湿 B、用pH试纸测得某溶液的pH为3 C、用500 mL容量瓶量取480 mL溶液 D、用50 mL量筒量取18.42 mL稀硫酸18. 在反应2Na2O2+2CO2=2Na2CO3+O2中,Na2O2是( )A、氧化剂 B、还原剂 C、既是氧化剂又是还原剂 D、既不是氧化剂也不是还原剂19. 下列除去杂质的方法中,正确的是( )A、除去N2中少量O2:通过灼热的炭层,收集气体 B、除去KCl溶液中少量的MgCl2:加入适量NaOH溶液,过滤 C、除去FeSO4溶液中少量的CuSO4:加入足量铁屑,充分反应后过滤 D、除去CO2中少量的HCl:将气体通入足量的NaOH溶液,收集气体20. 用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作.下列图示对应的操作规范的是( )A、 称量
B、
称量
B、 溶解
C、
溶解
C、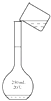 转移
D、
转移
D、 定容
21. 下列物质在水中的电离方程式错误的是( )A、NH4HCO3=N +HCO B、Ba(NO3)2=Ba2++2NO C、KAl(SO4)2=K++Al3++2SO D、Ca(OH)2=Ca2++(OH)22. 只用一种试剂就能鉴别KCl、K2CO3、Ba(NO3)2三种无色溶液,该试剂是( )A、稀盐酸 B、稀硫酸 C、硝酸银溶液 D、氯化钠溶液23. 设阿伏加德罗常数为NA , 则下列说法正确的是( )A、常温常压下2gH2的分子数小于NA B、1.8g的NH离子中含有的质子数为NA C、常温常压下1molMgCl2中含Cl-数为2NA D、常温常压下11.2L甲烷中含有的氢原子数为2NA24. 从200mL 6. 0 mol · L-1 Fe2(SO4)3溶液中取出10 mL稀释至200 mL,则稀释后溶液中SO的物质的量浓度是( )A、0.015 mol · L-1 B、0.045 mol ·L-1 C、0.30 mol · L-1 D、0.90 mol · L-125. 下列生活中的物质与其有效成分的化学式、用途的对应关系中,错误的是( )
定容
21. 下列物质在水中的电离方程式错误的是( )A、NH4HCO3=N +HCO B、Ba(NO3)2=Ba2++2NO C、KAl(SO4)2=K++Al3++2SO D、Ca(OH)2=Ca2++(OH)22. 只用一种试剂就能鉴别KCl、K2CO3、Ba(NO3)2三种无色溶液,该试剂是( )A、稀盐酸 B、稀硫酸 C、硝酸银溶液 D、氯化钠溶液23. 设阿伏加德罗常数为NA , 则下列说法正确的是( )A、常温常压下2gH2的分子数小于NA B、1.8g的NH离子中含有的质子数为NA C、常温常压下1molMgCl2中含Cl-数为2NA D、常温常压下11.2L甲烷中含有的氢原子数为2NA24. 从200mL 6. 0 mol · L-1 Fe2(SO4)3溶液中取出10 mL稀释至200 mL,则稀释后溶液中SO的物质的量浓度是( )A、0.015 mol · L-1 B、0.045 mol ·L-1 C、0.30 mol · L-1 D、0.90 mol · L-125. 下列生活中的物质与其有效成分的化学式、用途的对应关系中,错误的是( )选项
A
B
C
D
生活中的物质
食盐
熟石灰
复方氢氧化铝片
酒精
有效成分的化学式
NaCl
CaO
Al(OH)3
C2H5OH
用途
做调味品
干燥剂
做抗酸药
消毒
A、A B、B C、C D、D26. 根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )I2+SO2+2H2O=H2SO4+2HI;2FeCl2+Cl2=2FeCl3;2FeCl3+2HI=2FeCl2+2HCl+I2
A、I->Fe2+>Cl->SO2 B、Cl->Fe2+>SO2>I- C、Fe2+>I->Cl->SO2 D、SO2>I->Fe2+>Cl-二、填空题
-
27. 回答下列问题。(1)、下列物质中:①SO2;②液态氯化氢;③CH4;④熔融NaOH;⑤NH4Cl固体;⑥氨水。属于混合物的是(填序号,下同);能导电的是;属于电解质的是;属于非电解质的是。分别写出④和⑤的电离方程式:。(2)、2020年在抗击“新冠病毒”的战役中各种消毒试剂成为耀眼的明星,下面是几种常见的消毒药品:84消毒液(NaClO)、双氧水(H2O2)、臭氧(O3)、过氧乙酸(CH3COOOH)、氯气(Cl2)等。回答下面问题:
①过氧乙酸(CH3COOOH)的摩尔质量是。38gCH3COOOH中含有的O原子数为NA , 含有的H原子的物质的量为。
②过氧化氢(H2O2)极易分解,在MnO2催化作用下能完全分解为水和氧气,写出其化学方程式。过氧化氢的水溶液叫双氧水,2mol/L的双氧水500mL完全分解生成氧气的体积为L(标准状态),转移电子数为NA
③在相同状态下质量相同的臭氧和氯气,他们的物质的量之比为 , 原子个数之比为 , 密度之比为。
④84消毒液的有效成分为NaClO,同时还含有少量的NaCl,某84消毒液有效氯含量为3.55%,密度1.0g/mL,将此溶液稀释200倍后进行使用,此时c(NaClO) =mol/L。
28. 实验室配制500mL0.1mol/LNaOH溶液回答下列问题:(1)、应用托盘天平称取NaOH固体g。(2)、用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是____。A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求(3)、若实验加水时越过刻度线,溶液的浓度是;若定容时俯视刻度线,则配制的NaOH溶液浓度是(填“偏高”、“偏低”或“无影响”)。三、综合题
-
29. 某研究性学习小组查阅资料得知,漂白粉与盐酸溶液反应可制取氯气,化学方程式为Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O,他们设计如下装置制取氯气并验证其性质。请回答下列问题:
 (1)、该反应中的氧化剂是 , 氧化产物与还原产物物质的量之比是。方程式表示漂白粉在空气中的漂白原理。(2)、该实验中A部分的装置是(填字母)。
(1)、该反应中的氧化剂是 , 氧化产物与还原产物物质的量之比是。方程式表示漂白粉在空气中的漂白原理。(2)、该实验中A部分的装置是(填字母)。a.
 b.
b. c.
c. d.
d. (3)、装置B中饱和食盐水的作用是。(4)、装置C中的实验现象是。(5)、实验结束时发现装置E中有色布条并没有褪色,此时取下E装置,加入少量蒸馏水,塞紧塞子振荡,有色布条褪色,写出有色布条褪色的原因是:(用化学方程式和必要的文字说明)。(6)、装置F作用是 , 实验结束后为了检验溶液中含有Cl- , 请写出实验方案:。30. 将26.0 g锌投入250 mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:(1)、反应中生成的H2在标准状况下的体积?(2)、所用盐酸中HCl的物质的量浓度?
(3)、装置B中饱和食盐水的作用是。(4)、装置C中的实验现象是。(5)、实验结束时发现装置E中有色布条并没有褪色,此时取下E装置,加入少量蒸馏水,塞紧塞子振荡,有色布条褪色,写出有色布条褪色的原因是:(用化学方程式和必要的文字说明)。(6)、装置F作用是 , 实验结束后为了检验溶液中含有Cl- , 请写出实验方案:。30. 将26.0 g锌投入250 mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:(1)、反应中生成的H2在标准状况下的体积?(2)、所用盐酸中HCl的物质的量浓度?