浙江省衢温市“5 1”联盟2021-2022学年高二上学期期中联考化学试题
试卷更新日期:2022-06-30 类型:期中考试
一、单选题
-
1. 下列物质属于盐的是( )A、CH3COONa B、Ba(OH)2 C、H2SO4 D、SO32. 下列物质属于弱电解质的是( )A、CaCO3 B、CH3CH2OH C、H2O D、SO23. 下列物质的化学成分正确的是( )A、重晶石:BaSO3 B、胆矾:CuSO4·5H2O C、生石灰:Ca(OH)2 D、纯碱:NaHCO34. 下列仪器及其名称错误的是( )A、容量瓶
 B、烧杯
B、烧杯 C、碱式滴定管
C、碱式滴定管 D、分液漏斗
D、分液漏斗 5. 下列表示正确的是( )A、乙醇的空间充填模型:
5. 下列表示正确的是( )A、乙醇的空间充填模型: B、H2F+的电子式:
B、H2F+的电子式: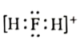 C、乙醛的结构简式:CH3COH
D、15N的原子结构示意图:
C、乙醛的结构简式:CH3COH
D、15N的原子结构示意图: 6. 下列说法正确的是( )A、O2-和O3互为同素异形体 B、二氯甲烷有两种同分异构体 C、H2O和D2O互为同位素 D、C2H6和C3H8互为同系物7. 下列食品添加剂中,其使用目的于反应速率有关的是( )A、抗氧化剂 B、着色剂 C、增味剂 D、调味剂8. 等质量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热完全分解得到氧气;②若不使用催化剂,加热至470℃左右充分反应,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法错误的是( )A、都属于氧化还原反应 B、发生还原反应的元素相同 C、发生氧化反应的元素不同 D、生成KCl的质量相同9. 下列有关物质性质与用途对应关系错误的是( )A、Al能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物 B、明矾水解生成氢氧化铝胶体,可用于水的净化 C、硅晶体具有半导体性能,可用于制芯片 D、能与碱反应,可用作焙制糕点的膨松剂10. 下列说法中,正确的是( )A、水凝结成冰的过程中,△H>0 △S>0 B、2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0 C、反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0 D、同一物质的固、液、气三种状态的熵值相同11. 下列各选项中,对杂质的检验与除去方法都正确的是( )
6. 下列说法正确的是( )A、O2-和O3互为同素异形体 B、二氯甲烷有两种同分异构体 C、H2O和D2O互为同位素 D、C2H6和C3H8互为同系物7. 下列食品添加剂中,其使用目的于反应速率有关的是( )A、抗氧化剂 B、着色剂 C、增味剂 D、调味剂8. 等质量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热完全分解得到氧气;②若不使用催化剂,加热至470℃左右充分反应,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法错误的是( )A、都属于氧化还原反应 B、发生还原反应的元素相同 C、发生氧化反应的元素不同 D、生成KCl的质量相同9. 下列有关物质性质与用途对应关系错误的是( )A、Al能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物 B、明矾水解生成氢氧化铝胶体,可用于水的净化 C、硅晶体具有半导体性能,可用于制芯片 D、能与碱反应,可用作焙制糕点的膨松剂10. 下列说法中,正确的是( )A、水凝结成冰的过程中,△H>0 △S>0 B、2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0 C、反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0 D、同一物质的固、液、气三种状态的熵值相同11. 下列各选项中,对杂质的检验与除去方法都正确的是( )选项
不纯物质
检验
除杂
A
NO2中混有少量NO
观察颜色
依次通过水、浓硫酸
B
甲烷中混有少量乙烯
溴水
依次通过酸性KMnO4溶液、浓硫酸
C
CO中混有少量CO2
澄清石灰水
依次通过氢氧化钠溶液、浓硫酸
D
Na2CO3溶液中混有少量NaHCO3
Ca(OH)2溶液
加入适量的NaOH溶液
A、A B、B C、C D、D12. 常温下,浓度均为0.1 mol/L的下列溶液中,粒子的物质的量的浓度关系正确的是( )A、氨水中,c()=c(OH-) B、Na2SO4溶液中,2c(Na+)=c() C、Na2CO3溶液中,c(Na+)=2c()+c()+c(H2CO3) D、NaHCO3溶液中,c(OH-)=c(H2CO3)-c()+c(H+)13. 下列反应的离子方程式书写正确的是( )A、向氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ B、足量氯气通入碘化亚铁溶液中:2Fe2++Cl2=2Fe3++2Cl- C、等体积等物质的量浓度的AlCl3、Ba(OH)2、HCl溶液混合:3H++Al3++6OH-=Al(OH)3↓+3H2O D、稀硫酸与氢氧化钡溶液的反应:SO+Ba2++H++OH-=H2O+BaSO4↓14. 化学与生产、生活、社会密切相关,下列说法错误的是( )A、“卤水点豆腐”属于蛋白质变性 B、绿色化学的核心思想是改变“先污染、后治理”的观念和做法 C、含氮、磷元素的大量污水任意排入近海水域,会出现水华、赤潮等水体污染问题 D、地沟油可以用来制造肥皂15. 四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知四种元素的原子最外层电子数之和为21,下列说法错误的是( ) A、X位于第二周期第ⅣA族 B、Z和W的最简单氢化物的热稳定性Z>W C、W的氧化物对应水化物的酸性一定比Y的强 D、简单离子半径:16. 室温时,下列说法正确的是:( )A、体积和物质的量浓度均相同的醋酸和盐酸,分别与NaOH固体反应后呈中性的溶液中:c(CH3COO-)<c(Cl-) B、pH=3的醋酸和pH=3的盐酸中分别加入足量锌粒,产生的氢气总量醋酸多 C、NaHA溶液呈酸性,可以推测H2A为强酸 D、可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐17. 类比推理是化学中常用的思维方法,下列推理正确的是( )A、MgCl2溶液低温蒸干得到Mg(OH)2 , NaCl溶液低温蒸干也可得到NaOH B、Na2O2与CO2反应生成Na2CO3与O2 , 推测Na2O2与SO2反应生成Na2SO3与O2 C、Fe与S在加热条件下生成FeS,则Cu与S在加热条件下生成CuS D、CO2为直线形分子,推测COS(氧硫化碳)也是直线形分子18. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、4.2gC3H6中一定存在数目为NA的碳碳双键 B、4.4gCO2中共用电子对的数目为0.4NA C、标准状况下,2.24L氯气和水充分反应转移电子数为0.1NA D、pH=1的硫酸溶液10L,含H+的数目为2NA19. 在一容积不变,绝热的密闭容器中发生可逆反应:2X(s)Y(g)+Z(g),以下不能说明该反应达到化学平衡状态的是( )A、体系温度不再变化 B、反应容器中Y的体积分数不变 C、混合气体密度不再变化 D、X的质量不再变化20. 已知在100℃、1.01×105Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法正确的是( )
A、X位于第二周期第ⅣA族 B、Z和W的最简单氢化物的热稳定性Z>W C、W的氧化物对应水化物的酸性一定比Y的强 D、简单离子半径:16. 室温时,下列说法正确的是:( )A、体积和物质的量浓度均相同的醋酸和盐酸,分别与NaOH固体反应后呈中性的溶液中:c(CH3COO-)<c(Cl-) B、pH=3的醋酸和pH=3的盐酸中分别加入足量锌粒,产生的氢气总量醋酸多 C、NaHA溶液呈酸性,可以推测H2A为强酸 D、可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐17. 类比推理是化学中常用的思维方法,下列推理正确的是( )A、MgCl2溶液低温蒸干得到Mg(OH)2 , NaCl溶液低温蒸干也可得到NaOH B、Na2O2与CO2反应生成Na2CO3与O2 , 推测Na2O2与SO2反应生成Na2SO3与O2 C、Fe与S在加热条件下生成FeS,则Cu与S在加热条件下生成CuS D、CO2为直线形分子,推测COS(氧硫化碳)也是直线形分子18. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、4.2gC3H6中一定存在数目为NA的碳碳双键 B、4.4gCO2中共用电子对的数目为0.4NA C、标准状况下,2.24L氯气和水充分反应转移电子数为0.1NA D、pH=1的硫酸溶液10L,含H+的数目为2NA19. 在一容积不变,绝热的密闭容器中发生可逆反应:2X(s)Y(g)+Z(g),以下不能说明该反应达到化学平衡状态的是( )A、体系温度不再变化 B、反应容器中Y的体积分数不变 C、混合气体密度不再变化 D、X的质量不再变化20. 已知在100℃、1.01×105Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法正确的是( ) A、1molH2O(g)分解为2molH与1molO时放出930kJ热量 B、热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-490kJ·mol-1 C、甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙 D、乙→丙的过程中若生成液态水,释放的能量将小于930kJ21. 氨不仅应用于化肥生产,也可以应用于能源领域,与氢氧燃料电池比,氨氧燃料电池有其独特优势,某研究小组设计的氨氧燃料电池装置如图,下列有关说法正确的是( )
A、1molH2O(g)分解为2molH与1molO时放出930kJ热量 B、热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-490kJ·mol-1 C、甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙 D、乙→丙的过程中若生成液态水,释放的能量将小于930kJ21. 氨不仅应用于化肥生产,也可以应用于能源领域,与氢氧燃料电池比,氨氧燃料电池有其独特优势,某研究小组设计的氨氧燃料电池装置如图,下列有关说法正确的是( ) A、电极2为负极,发生氧化反应 B、电极1的电极反应式为:2NH3-6e-=N2↑+6H+ C、放电过程中溶液中的OH-朝正极移动 D、标准状况下,2.24 LO2参加反应,转移电子数为0.4NA22. 工业合成三氧化硫的反应为2SO2(g)+O2(g) 2SO3(g),△H=-198kJ/mol,反应过程可用如图模拟(
A、电极2为负极,发生氧化反应 B、电极1的电极反应式为:2NH3-6e-=N2↑+6H+ C、放电过程中溶液中的OH-朝正极移动 D、标准状况下,2.24 LO2参加反应,转移电子数为0.4NA22. 工业合成三氧化硫的反应为2SO2(g)+O2(g) 2SO3(g),△H=-198kJ/mol,反应过程可用如图模拟( 表示O2 ,
表示O2 ,  表示SO2 ,
表示SO2 ,  表示催化剂)。下列说法错误的是( )
表示催化剂)。下列说法错误的是( ) A、过程Ⅱ和过程Ⅲ决定了全部反应进行的程度 B、催化剂提高了分子能量,从而使单位体积中活化分子百分数增大,化学反应速率加快 C、过程Ⅱ为吸热过程,过程Ⅲ为放热过程;升高温度,过程Ⅱ、过程Ⅲ速率均加快 D、1molSO2和0.5molO2反应,放出的热量小于99kJ23. 一定压强下,向10L密闭容器中充入1molS2Cl2(g)和1molCl2 , 发生反应:S2Cl2(g)+Cl2(g)⇌2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中错误的是( )
A、过程Ⅱ和过程Ⅲ决定了全部反应进行的程度 B、催化剂提高了分子能量,从而使单位体积中活化分子百分数增大,化学反应速率加快 C、过程Ⅱ为吸热过程,过程Ⅲ为放热过程;升高温度,过程Ⅱ、过程Ⅲ速率均加快 D、1molSO2和0.5molO2反应,放出的热量小于99kJ23. 一定压强下,向10L密闭容器中充入1molS2Cl2(g)和1molCl2 , 发生反应:S2Cl2(g)+Cl2(g)⇌2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中错误的是( ) A、A,B,C,D四点对应状态下,达到平衡状态的是B,D B、正反应的活化能大于逆反应的活化能 C、对于该反应,平衡常数K随温度的升高而减小 D、在300℃下,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率不变24. 常温下,向10mL0.05mol·L-1的某酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列说法错误的是( )
A、A,B,C,D四点对应状态下,达到平衡状态的是B,D B、正反应的活化能大于逆反应的活化能 C、对于该反应,平衡常数K随温度的升高而减小 D、在300℃下,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率不变24. 常温下,向10mL0.05mol·L-1的某酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列说法错误的是( ) A、常温下,0.1mol·L-1KHB溶液的pH=1 B、过程中,随着氨水的加入,溶液pH先增后减 C、D,E,F三点中,D点水的电离程度最大 D、B点溶液呈酸性,F点溶液c(NH )=2c(B2-)25. 下列实验操作、现象和所得到的结论均正确的是( )
A、常温下,0.1mol·L-1KHB溶液的pH=1 B、过程中,随着氨水的加入,溶液pH先增后减 C、D,E,F三点中,D点水的电离程度最大 D、B点溶液呈酸性,F点溶液c(NH )=2c(B2-)25. 下列实验操作、现象和所得到的结论均正确的是( )选项
实验内容
实验结论
A
将Fe(NO3)2样品溶于H2SO4后,加入KSCN,溶液显红色
Fe(NO3)2已经氧化变质
B
取1 mL0.1 mol/L KI溶液于试管中,加入5 mL0.1 mol/LFeCl3 , 充分反应后滴入5滴15%KSCN溶液
若溶液变血红色,则KI和FeCl3反应有一定限度
C
向2支盛有5 mL不同浓度NaHSO3溶液的试管中,同时加入2 mL 5% H2O2溶液,观察并比较实验现象
探究浓度对反应速率的影响
D
用pH试纸测定NaCl和NaF溶液的pH,pH(NaCl)<pH(NaF)
结合H+能力:Cl-<F-
A、A B、B C、C D、D二、综合题
-
26. 回答下列问题:(1)、NaClO溶液呈碱性,用离子方程式表示其原因。(2)、5.2g乙炔(C2H2)气体完全燃烧生成二氧化碳和液态水,放出259.9kJ的热量,写出反应的热化学方程式。(3)、H2O比H2S 的熔沸点高,原因是:。(4)、25℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,若溶液中c(NH)= c(Cl-),则氨水的电离平衡常数。(5)、在25℃时,醋酸和亚硫酸的电离常数如下表:
醋酸
亚硫酸
K=1.8×10-5
K1=1.54×10-2
K2=1.02×10-7
醋酸滴入Na2SO3溶液中,反应的离子方程式为
27. 当今,世界多国相继规划了碳达峰、碳中和的时间节点,因此研发二氧化碳利用技术降低空气中二氧化碳含量成了研究热点。(1)、Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:
CO2(g)+3H2(g) H2O(g)+CH3OH(g) △H
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g) CO(g)+H2O(g) △H1=41kJ/mol
②CO(g)+2H2(g) CH3OH(g) △H2= -90 kJ/mol
△H=kJ/mol
(2)、一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为 bmol,此时H2O(g)的浓度为mol·L-1(用含a、b、V的代数式表示,下同)反应①的平衡常数为。(3)、反应CO2(g)+3H2(g) H2O(g)+CH3OH(g)在I、Ⅱ是在两种不同催化剂作用下建立平衡过程中,CO2的转化率[α(CO2)]随时间(t)的变化曲线:
活化能过程I 过程Ⅱ(填“<”,“>”,“=”),t2时刻改变了某一反应条件,下列说法正确的是
A.恒温恒压,t2时刻通入惰性气体
B.恒温恒容,t2时刻通入一定量氢气
C.t2时刻升高温度
D.t2时刻,移走了一部分水蒸气
(4)、Ⅱ.以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应(均自发进行)可表示:反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s); ΔH1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(l); ΔH2
反应Ⅲ:2NH3(g)+CO2(gCO(NH2)2(s)+H2O(g); ΔH3
某研究小组为探究反应Ⅲ影响CO2转化率的因素,在其它条件一定时,图为CO2转化率受温度变化影响的曲线。

当温度高于T℃后,CO2转化率变化趋势如图所示,其原因是。(不考虑催化剂活性变化)
(5)、在某恒定温度下,将NH3和CO2物质的量之比按2:1充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计且只发生反应Ⅰ),经15min达到平衡,各物质浓度的变化曲线如图所示。若保持平衡的温度和体积不变,25min时再向该容器中充入2molNH3和1molCO2 , 在40 min时重新达到平衡,请在图中画出25~50min内CO2的浓度变化趋势曲线。 28. 某合金(仅含铜、铁)中铜和铁的物质的量之和为 amol,其中Cu的物质的量分数为 b,将其全部投入c mol的稀硝酸中,加热使其充分反应(假设NO是唯一的还原产物)。(1)、若产生标准状况下NO 4.48 L,则反应转移电子的物质的量为mol(2)、若b=0.2,溶液中的Fe3+与Fe2+的物质的量相等,标准状况下产生NO6.72L,则c=mol29. 化合物X在工业、农业生产中都有重要用途,X由4种常见元素组成,某兴趣小组展开如下实验(气体的体积均在标准状况下测得):
28. 某合金(仅含铜、铁)中铜和铁的物质的量之和为 amol,其中Cu的物质的量分数为 b,将其全部投入c mol的稀硝酸中,加热使其充分反应(假设NO是唯一的还原产物)。(1)、若产生标准状况下NO 4.48 L,则反应转移电子的物质的量为mol(2)、若b=0.2,溶液中的Fe3+与Fe2+的物质的量相等,标准状况下产生NO6.72L,则c=mol29. 化合物X在工业、农业生产中都有重要用途,X由4种常见元素组成,某兴趣小组展开如下实验(气体的体积均在标准状况下测得):
已知:①X的摩尔质量为454g·mol-1;②化合物B常温下是常见的液体;③混合气体C能使品红溶液褪色,气体E能使带火星的木条复燃。
请回答:
(1)、白色沉淀F的化学式是 , 化合物X的化学式是。(2)、混合气体C与足量氯水反应的离子方程式为。(3)、化合物X高温分解的化学方程式为。(4)、蓝色溶液G 与NaOH溶液发生非氧化还原反应可制得X,化学方程式为。30. 污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。利用软锰矿(主要成分为MnO2 , 含少量铁、铝、铜、镍等金属化合物)作脱硫剂,脱除燃煤尾气中的SO2并制得MnO2的流程如下:
回答下列问题:
(1)、I.过滤操作时需要用到的玻璃仪器有。(2)、下列各组试剂中,能检验“尾气”中SO2是否除尽的是____(填序号)。A、氯化钡溶液 B、稀硫酸酸化的KMnO4溶液 C、碘水和淀粉的混合溶液 D、NaOH溶液(3)、步骤IV中发生反应的离子方程式为。(4)、II.可利用滴定法来测定尾气中SO2的含量,实验室按以下步骤进行:①取标况下1000 mL尾气样品,通入适量NaOH溶液中;
②配制成250 mL溶液;
③准确量取25.00 mL;
④将25.00 mL溶液置于锥形瓶中;
⑤用0.0100 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00 mL溶液。
滴定达到终点的现象是
(5)、该尾气中SO2的含量为g/L(6)、以下操作会造成测定结果偏低的是____A、达到滴定终点读取数据时,俯视视滴定管液面 B、锥形瓶未用待测液润洗 C、盛装标准溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失 D、溶液颜色变化后,立即读数