贵州省遵义市2021-2022学年高二上学期期中质量检测化学试题
试卷更新日期:2022-06-30 类型:期中考试
一、单选题
-
1. 化学与工农业生产、日常生活、材料等有密切的联系,下列说法正确的是( )A、某公司自主研发的“麒麟9000芯片”的主要成分是高纯度的二氧化硅 B、医用酒精与次氯酸钠溶液是家庭采购和使用最多的消毒液,两者消毒原理相同 C、浓硫酸具有强腐蚀性,可用浓硫酸蚀刻石英制艺术品 D、“可燃冰”是一种有待大量开发的新能源,其主要成分为甲烷水合物2. 下列过程的能量变化与如图所示相符的是( )
 A、浓硫酸的稀释 B、木炭的燃烧 C、盐酸与碳酸氢钠的反应 D、生石灰与水的反应3. 已知反应 , 该反应的平衡常数表达式为( )A、 B、 C、 D、4. 分类法是一种行之有效、简单易行的科学方法。下列物质分类或归类正确的是( )A、有机高分子化合物:糖类、油脂、蛋白质、聚乙烯塑料 B、同素异形体:、碳纳米管、金刚石、石墨 C、化合物: D、电解质:胆矾、碳酸钡、冰醋酸、盐酸5. 已知反应在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )A、 B、 C、 D、6. 常温下,下列电解质在水中电离的电离方程式正确的是( )A、HF=H++F- B、H2S⇌2H++S2- C、Ca(HCO3)2⇌Ca2+ +2HCO D、K2SO3=+2K+7. 一定条件下进行反应。达到平衡后,时刻改变某一反应条件所得图像如图,则改变的条件为( )
A、浓硫酸的稀释 B、木炭的燃烧 C、盐酸与碳酸氢钠的反应 D、生石灰与水的反应3. 已知反应 , 该反应的平衡常数表达式为( )A、 B、 C、 D、4. 分类法是一种行之有效、简单易行的科学方法。下列物质分类或归类正确的是( )A、有机高分子化合物:糖类、油脂、蛋白质、聚乙烯塑料 B、同素异形体:、碳纳米管、金刚石、石墨 C、化合物: D、电解质:胆矾、碳酸钡、冰醋酸、盐酸5. 已知反应在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )A、 B、 C、 D、6. 常温下,下列电解质在水中电离的电离方程式正确的是( )A、HF=H++F- B、H2S⇌2H++S2- C、Ca(HCO3)2⇌Ca2+ +2HCO D、K2SO3=+2K+7. 一定条件下进行反应。达到平衡后,时刻改变某一反应条件所得图像如图,则改变的条件为( )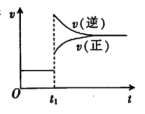 A、增大压强 B、升高温度 C、加催化剂 D、增大生成物浓度8. 下列关于气态的凝华成干冰的过程中焓变和熵变的判断均正确的是( )A、 B、 C、 D、9. 表示阿伏加德罗常数的值,下列说法正确的是( )A、乙烯含有的共用电子对数为 B、常温下,足量溶液与反应,转移的电子总数为 C、苯基丙烯(
A、增大压强 B、升高温度 C、加催化剂 D、增大生成物浓度8. 下列关于气态的凝华成干冰的过程中焓变和熵变的判断均正确的是( )A、 B、 C、 D、9. 表示阿伏加德罗常数的值,下列说法正确的是( )A、乙烯含有的共用电子对数为 B、常温下,足量溶液与反应,转移的电子总数为 C、苯基丙烯( )中含有碳碳双键的数目为
D、标准状况下,乙醇所含的分子数为
10. 一定温度下,在容积不变的密闭容器中,发生反应 , 当反应达到平衡后,下列说法正确的是( )A、降低温度,该反应的平衡常数K减小 B、该反应的平衡常数 C、保持其他条件不变,移除部分的转化率增大 D、保持其他条件不变,升高温度,11. 较纯的可用于原电池法生产硫酸(如图所示,电极a、b均为电极,气体已换算成标准状况下),下列说法错误的是( )
)中含有碳碳双键的数目为
D、标准状况下,乙醇所含的分子数为
10. 一定温度下,在容积不变的密闭容器中,发生反应 , 当反应达到平衡后,下列说法正确的是( )A、降低温度,该反应的平衡常数K减小 B、该反应的平衡常数 C、保持其他条件不变,移除部分的转化率增大 D、保持其他条件不变,升高温度,11. 较纯的可用于原电池法生产硫酸(如图所示,电极a、b均为电极,气体已换算成标准状况下),下列说法错误的是( ) A、电池总反应为 B、电极b的反应式为 C、电路中每转移电子,消耗 D、电极a发生氧化反应,得到电子12. 已知X、Y、Z三种元素均为短周期主族元素,X、Z同周期,X、Z的最低价离子分别为X2-和Z- , Y2+和Z-具有相同的电子层结构,下列说法正确的是( )A、原子半径:Z>X B、X、Y两种元素形成的化合物YX为共价化合物 C、Z的单质与X的最简单氢化物反应可得到X的单质 D、工业上常采用电解Y的氯化物的水溶液来获得Y的单质13. 下列图示与对应的叙述相符的是( )
A、电池总反应为 B、电极b的反应式为 C、电路中每转移电子,消耗 D、电极a发生氧化反应,得到电子12. 已知X、Y、Z三种元素均为短周期主族元素,X、Z同周期,X、Z的最低价离子分别为X2-和Z- , Y2+和Z-具有相同的电子层结构,下列说法正确的是( )A、原子半径:Z>X B、X、Y两种元素形成的化合物YX为共价化合物 C、Z的单质与X的最简单氢化物反应可得到X的单质 D、工业上常采用电解Y的氯化物的水溶液来获得Y的单质13. 下列图示与对应的叙述相符的是( )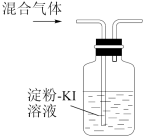
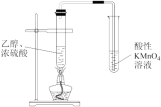
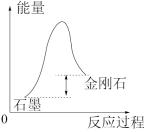
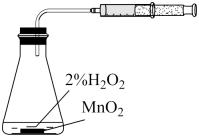
A.检验中是否混有溴蒸气
B.检验有乙烯生成
C.石墨比金刚石稳定
D.注射器的活塞右移则该反应为放热反应
A、A B、B C、C D、D14. 苹果酸首先是从苹果汁中分离出来的,是苹果汁酸味的来源,并因此得名,存在于苹果、葡萄、山楂等果实中。它也用作食品添加剂,能发生如图转化,下列有关说法正确的是( ) A、苹果酸和香豆酸均能与溴水发生加成反应 B、香豆酸的分子式为C6H6O4 C、苹果酸、香豆酸均含三种官能团 D、苹果酸、香豆酸均能与NaHCO3反应15. 在某恒容密闭容器中进行反应: 。已知:反应开始时, , , 。在一定条件下,当反应达到平衡时,下列各物质的浓度关系可能存在的是( )A、 B、 C、 D、16. 已知时有关弱酸的电离平衡常数如表所示.
A、苹果酸和香豆酸均能与溴水发生加成反应 B、香豆酸的分子式为C6H6O4 C、苹果酸、香豆酸均含三种官能团 D、苹果酸、香豆酸均能与NaHCO3反应15. 在某恒容密闭容器中进行反应: 。已知:反应开始时, , , 。在一定条件下,当反应达到平衡时,下列各物质的浓度关系可能存在的是( )A、 B、 C、 D、16. 已知时有关弱酸的电离平衡常数如表所示.弱酸
电离常数
下列说法错误的是( )
A、酸性: B、反应可以发生 C、相同物质的量浓度的四种溶液中由水电离出的:溶液溶液溶液溶液 D、与的结合能力比与的结合能力弱二、综合题
-
17. 某学生通过测定反应过程中所放出的热量来计算中和反应的反应热,将盐酸与溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸和碱的密度、比热容与水的相同)。回答下列问题:
 (1)、仪器a的名称为 , 其作用是。(2)、实验中改用盐酸和溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”,下同);生成时放出的热量 , 理由是。(3)、若用等物质的量的固体进行上述实验,测得的中和反应的反应热的绝对值将(填“偏大”、“偏小”或“无影响”)。(4)、若四次操作测得终止温度与起始温度差分别为①、②、③、④ , 则所得的中和反应的反应热(已知该温度下水的比热容: , 忽略量热计的比热容,保留三位有效数字)。18. 某化学兴趣小组设计实验探究钠分别与乙醇、乙酸反应的反应速率。已学知识:
(1)、仪器a的名称为 , 其作用是。(2)、实验中改用盐酸和溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”,下同);生成时放出的热量 , 理由是。(3)、若用等物质的量的固体进行上述实验,测得的中和反应的反应热的绝对值将(填“偏大”、“偏小”或“无影响”)。(4)、若四次操作测得终止温度与起始温度差分别为①、②、③、④ , 则所得的中和反应的反应热(已知该温度下水的比热容: , 忽略量热计的比热容,保留三位有效数字)。18. 某化学兴趣小组设计实验探究钠分别与乙醇、乙酸反应的反应速率。已学知识:①羟基与羧基中氢的活性:羟基羧基。
②
物质
钠
乙醇
冰醋酸
密度/()
0.968
0.789
1.05
(1)、依据所学知识预测:反应速率更快的是钠与(填“乙醇”或“乙酸”)的反应。(2)、实验1:将无水乙酸和无水乙醇分别加入两个相同的烧杯中,取两块形状大小几乎一样的金属钠(都约为),分别同时投入上述两个烧杯中,观察反应现象并记录金属钠完全溶解所需要的时间。(实验在常温下完成,下同)
请完成下表:反应物
实验现象
钠完全溶解所需时间
钠与无水乙酸
钠 , 产生气泡较慢
钠与无水乙醇
钠 , 产生气泡较快
(3)、依据实验现象,有同学指出实验1设计存在缺陷,该缺陷是;改进的措施是。【实验结论】钠与无水乙醇反应的反应速率比钠与无水乙酸反应的反应速率快得多。
(4)、【查阅资料】探究钠与水反应的反应速率的影响因素:①金属失电子的过程:
②金属离子离开的过程:
③活性氢得电子的过程:
④分子离开的过程:
猜想原因:对照钠与水反应的反应速率的影响因素,钠与无水乙醇或无水乙酸反应的反应速率主要是由第②个因素决定的,即由生成的乙酸钠(或乙醇钠)在无水乙酸(或无水乙醇)中的决定。
(5)、设计实验验证猜想:将无水乙酸和无水乙醇分别加入两个相同的烧杯中,。19. 在标准状况下,仅由C、H两种元素组成的气体M的质量为。在、下完全燃烧生成和 , 放出的热量,回答下列问题:(1)、的物质的量为 , 分子式为。(2)、表示M燃烧热的热化学方程式为 , 每生成 , 转移的电子数为。(3)、已知:。在上述条件下,由和一定量M组成的混合气体完全燃烧生成和 , 同时放出的热量。①混合气体中的物质的量为。
②将完全燃烧后所得的通入溶液中,完全反应后所得溶液中的溶质为(填化学式,不考虑气体逸出)。
③已知:。则M完全燃烧生成和所放出的热量为。
20. 当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发 利用技术、降低空气中 含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。(1)、 催化加氢制甲醇一定温度下,在某恒容密闭容器中充入一定量的 和 ,发生反应: 。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
A、混合气体的密度不再随时间变化而改变 B、气体的压强不再随时间变化而改变 C、 的物质的量分数不再随时间变化而改变 D、单位时间内每形成 键,同时断裂 键(2)、 催化加氢合成乙烯在 某恒容密闭容器中,充入 和 ,发生反应: 。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
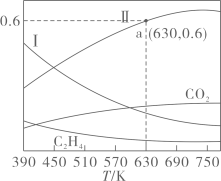
①该反应的 (填“>”或“<”)0,曲线Ⅰ和曲线Ⅱ分别表示(填化学式,下同)和的变化曲线。
②根据图中a点,计算该温度下平衡时的 , , 的平衡转化率为 (保留三位有效数字)。
③若平衡时a点容器内气体的总压强为 ,则该反应的平衡常数 (列出计算式,用分压表示,分压 总压 物质的量分数)。
(3)、 用途广泛,写出其基于物理性质的一种用途:。