安徽省宣城市六校2021-2022学年高二上学期期中联考化学试题
试卷更新日期:2022-06-30 类型:期中考试
一、单选题
-
1. 下列化学反应的△H<0的是( )A、Ba(OH)2•8H2O晶体与NH4Cl晶体混合 B、氯化铵分解得氨气 C、实验室制备氢气 D、碳酸钙分解得氧化钙2. 热化学方程式中,物质的化学计量数代表的意义是( )A、体积 B、物质的量 C、浓度 D、个数3. 在25℃和101kPa下,根据如图所示的H2(g)和Cl2(g)反应生成HCl(g)过程中能量变化情况,判断下列说法错误的是( )
 A、1molH2和1molCl2的反应热△H=+183kJ•mol-1 B、2mol气态氢原子结合生成H2(g)时,能放出436kJ能量 C、断裂1molHCl分子中的化学键,需要吸收431kJ能量 D、如图所示,该反应中反应物所具有的总能量高于生成物所具有的总能量4. 固态或气态碘分别与氢气反应的热化学方程式如下:
A、1molH2和1molCl2的反应热△H=+183kJ•mol-1 B、2mol气态氢原子结合生成H2(g)时,能放出436kJ能量 C、断裂1molHCl分子中的化学键,需要吸收431kJ能量 D、如图所示,该反应中反应物所具有的总能量高于生成物所具有的总能量4. 固态或气态碘分别与氢气反应的热化学方程式如下:①I2(?)+H2(g)2HI(g) △H1=-9.48kJ•mol-1
②I2(?)+H2(g)2HI(g) △H2=+26.48kJ•mol-1
下列判断错误的是( )
A、①中的I2为气态,②中的I2为固态 B、②中反应物总能量比①中反应物总能量低 C、1mol固态碘升华时将吸热35.96kJ D、产物的热稳定性:反应①>反应②5. 在容积不变的密闭容器中,A与B反应生成C,其化学反应速率分别用v(A)、v(B)、v(C)表示。已知:2v(B)=3v(A),3v(C)=2v(B),则此反应可表示为( )A、2A+3B=2C B、A+3B=2C C、3A+B=2C D、A+B=C6. 硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O。下列各项实验中,该化学反应的反应速率最快的是( )实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol•L-1)
V/mL
c/(mol•L-1)
V/mL
A
10
5
0.2
5
0.1
10
B
10
5
0.1
5
0.1
10
C
30
5
0.1
5
0.1
10
D
30
5
0.2
5
0.2
10
A、A B、B C、C D、D7. 使用催化剂能加快反应速率的主要原因是( )A、加快了分子运动的速率 B、降低了反应物分子的能量 C、减小了活化分子的百分数 D、降低了反应的活化能8. 利用下列实验装置能完成相应实验的是( )A、 该装置(秒表未画出)测定化学反应速率
B、
该装置(秒表未画出)测定化学反应速率
B、 该装置制取HCl并吸收尾气
C、
该装置制取HCl并吸收尾气
C、 该装置制备纯净的NH3
D、
该装置制备纯净的NH3
D、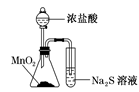 该装置比较MnO2、Cl2、S的氧化性
9. 已知: , 则的反应热是( )A、 B、 C、 D、10. 反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
该装置比较MnO2、Cl2、S的氧化性
9. 已知: , 则的反应热是( )A、 B、 C、 D、10. 反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )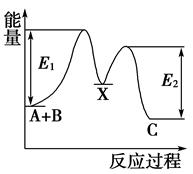 A、E2表示反应X→C的活化能 B、X是反应A+B→C的催化剂 C、反应A+B→C的ΔH<0 D、加入催化剂可改变反应A+B→C的焓变11. 航天燃料从液态变为固态,是一项技术突破。铍是高效率的火箭材料,燃烧时放出巨大的能量,每千克固态铍完全燃烧放出的热量为62700kJ,则铍燃烧的热化学方程式正确的是( )A、Be(s)+O2(g)=BeO(s) △H=-564.3kJ•mol-1 B、Be(s)+O2(g)=BeO(g) △H=-62700kJ•mol-1 C、Be(s)+O2(g)=BeO(s) △H=+564.3kJ•mol-1 D、Be+O2=BeO △H=-564.3kJ•mol-112. 金属插入CH4的C—H键形成高氧化态过渡金属化合物的反应频繁出现在光分解作用、金属有机化学等领域,如图是CH4与Zr形成过渡金属化合物的过程。下列说法错误的是( )
A、E2表示反应X→C的活化能 B、X是反应A+B→C的催化剂 C、反应A+B→C的ΔH<0 D、加入催化剂可改变反应A+B→C的焓变11. 航天燃料从液态变为固态,是一项技术突破。铍是高效率的火箭材料,燃烧时放出巨大的能量,每千克固态铍完全燃烧放出的热量为62700kJ,则铍燃烧的热化学方程式正确的是( )A、Be(s)+O2(g)=BeO(s) △H=-564.3kJ•mol-1 B、Be(s)+O2(g)=BeO(g) △H=-62700kJ•mol-1 C、Be(s)+O2(g)=BeO(s) △H=+564.3kJ•mol-1 D、Be+O2=BeO △H=-564.3kJ•mol-112. 金属插入CH4的C—H键形成高氧化态过渡金属化合物的反应频繁出现在光分解作用、金属有机化学等领域,如图是CH4与Zr形成过渡金属化合物的过程。下列说法错误的是( ) A、整个反应快慢,由CH2—Zr···H2→状态2反应决定 B、Zr+CH4→CH3—Zr···H活化能为213.67kJ•mol-1 C、在中间产物中CH3—Zr···H状态最稳定 D、Zr+CH4→CH—Zr···H3 ΔH=+39.54kJ•mol-113. 研究反应的速率影响因素,在不同条件下进行4组实验,起始浓度为0,反应物的浓度随反应时间(min)的变化情况如图所示。下列说法错误的是( )
A、整个反应快慢,由CH2—Zr···H2→状态2反应决定 B、Zr+CH4→CH3—Zr···H活化能为213.67kJ•mol-1 C、在中间产物中CH3—Zr···H状态最稳定 D、Zr+CH4→CH—Zr···H3 ΔH=+39.54kJ•mol-113. 研究反应的速率影响因素,在不同条件下进行4组实验,起始浓度为0,反应物的浓度随反应时间(min)的变化情况如图所示。下列说法错误的是( ) A、比较实验②、④得出:升高温度,化学反应速率加快 B、比较实验①、④得出:升高温度,化学反应速率加快 C、实验③有可能使用了催化剂,催化剂加快正反应速率,对逆反应无影响 D、在0~10min之间,实验②的平均速率14. 分别在T1℃、T2℃、T3℃时,向三个500mL的恒容密闭容器中均充入1molN2和2.5molH2 , 发生反应:N2(g)+3H2(g)2NH3(g) △H<0。实验测得反应tmin时N2的体积分数如图所示。下列说法正确的是( )
A、比较实验②、④得出:升高温度,化学反应速率加快 B、比较实验①、④得出:升高温度,化学反应速率加快 C、实验③有可能使用了催化剂,催化剂加快正反应速率,对逆反应无影响 D、在0~10min之间,实验②的平均速率14. 分别在T1℃、T2℃、T3℃时,向三个500mL的恒容密闭容器中均充入1molN2和2.5molH2 , 发生反应:N2(g)+3H2(g)2NH3(g) △H<0。实验测得反应tmin时N2的体积分数如图所示。下列说法正确的是( ) A、tmin时,Ⅱ和Ⅲ一定达到平衡 B、2v(NH3)=3v(H2)时,三容器均达平衡状态 C、平衡后容器Ⅰ中混合气体平均相对分子质量最小 D、已知tmin时,Ⅲ中c(N2)=1mol•L-1 , 此时反应平衡常数K=0.5
A、tmin时,Ⅱ和Ⅲ一定达到平衡 B、2v(NH3)=3v(H2)时,三容器均达平衡状态 C、平衡后容器Ⅰ中混合气体平均相对分子质量最小 D、已知tmin时,Ⅲ中c(N2)=1mol•L-1 , 此时反应平衡常数K=0.5二、填空题
-
15. 化学发展的过程就是人类研究和利用化学反应的过程。回答下列问题:(1)、某一过程是放热还是吸热,取决于焓变(终态和始态的焓值差)。相同条件下1mol氢分子与2mol氢原子相比,焓更高的是。(2)、实验室进行铁与硫反应的实验时,将硫研细再与铁粉混匀进行反应,这样做的目的是。(3)、已知:稀溶液中H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ•mol-1 , 稀硫酸与稀KOH溶液反应生成1mol水时放热等于57.3kJ,请解释:。16. 为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。回答下列问题:
 (1)、该反应为(填“放热”或“吸热”)反应。(2)、反应物A和B的总能量比生成物C和D的总能量(填“高”或低”)。(3)、该反应过程中,物质中的能通过化学反应转化成能释放出来。(4)、该反应过程中,反应物化学键断裂吸收的能量(填“高”或“低”)于生成物化学键形成放出的能量。(5)、下列反应符合题中实验现象的是____(填标号)。A、2Al+6HCl=2AlCl3+3H2↑ B、2Na+2H2O=2NaOH+H2↑ C、NaOH+HCl=NaCl+H2O D、Na2O2+2CO2=2Na2CO3+O217. 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6 , 空气充足时生成P4O10。回答下列问题:(1)、已知298K时,白磷、红磷完全燃烧的热化学方程式如下:
(1)、该反应为(填“放热”或“吸热”)反应。(2)、反应物A和B的总能量比生成物C和D的总能量(填“高”或低”)。(3)、该反应过程中,物质中的能通过化学反应转化成能释放出来。(4)、该反应过程中,反应物化学键断裂吸收的能量(填“高”或“低”)于生成物化学键形成放出的能量。(5)、下列反应符合题中实验现象的是____(填标号)。A、2Al+6HCl=2AlCl3+3H2↑ B、2Na+2H2O=2NaOH+H2↑ C、NaOH+HCl=NaCl+H2O D、Na2O2+2CO2=2Na2CO3+O217. 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6 , 空气充足时生成P4O10。回答下列问题:(1)、已知298K时,白磷、红磷完全燃烧的热化学方程式如下:P4(白磷,s)+5O2(g)=P4O10(s) △H1=-2983.2kJ•mol-1
P(红磷,s)+O2(g)=P4O10(s) △H2=-738.5kJ•mol-1
则该温度下,白磷转化为红磷的热化学方程式为。
(2)、已知298K时白磷不完全燃烧的热化学方程式为P4(白磷,s)+3O2(g)=P4O6(s) △H=-1638kJ•mol-1。在某密闭容器中加入62g白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 , 反应过程中放出的热量为kJ(保留2位小数)。18. 有人利用碳还原法将氮氧化物(以NO为例)转化为无毒无害的气体。回答下列问题:(1)、碳还原法发生反应的化学方程式为C(s)+2NO(g)N2(g)+CO2(g)。能使化学反应速率加快的措施有(填序号,下同),其中属于增大活化分子百分含量的是。①增加C的物质的量②定容密闭容器中继续充入NO③在反应器中加入NaOH溶液④升高反应温度⑤缩小容器体积
(2)、向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如表所示:时间/min
浓度/(mol•L-1)
物质
0
10
20
30
NO
1.00
0.68
0.50
0.50
N2
0
0.16
0.25
0.25
CO2
0
0.16
0.25
0.25
①10~20min内,N2的平均反应速率v(N2)=。
②在30min时向容器中加入合适催化剂,v(正) , v(逆)。(填“增大”“减小”或“不变”)
19. 某同学用50 mL0.50 mol•L-1盐酸与50 mL0.55 mol•L-1NaOH溶液,在如图所示的装置中进行,测定强酸与强碱中和反应的反应热。回答下列问题: (1)、图中有处必要的仪器或用品未画出,它是。(2)、向小烧杯中倒入NaOH溶液的正确操作是(填标号)。
(1)、图中有处必要的仪器或用品未画出,它是。(2)、向小烧杯中倒入NaOH溶液的正确操作是(填标号)。a.沿玻璃棒缓慢倒入
b.分三次少量倒入
c.一次迅速倒入
(3)、装置中加隔热层的目的是。(4)、该同学实验记录的数据如表所示:实验次数
起始温度/℃
终止温度/℃
温度差/℃
HCl
NaOH
平均值
1
25.5
25.0
25.25
28.63
3.38
2
24.5
24.2
24.35
27.74
3.39
3
25
24.2
24.75
28.15
3.40
表中记录的终止温度是指 , 根据上表数据计算中和反应的反应热△H=(近似认为实验所用盐酸和NaOH溶液的密度都是1 g•cm-3 , 中和后溶液的比热容c为4.18 J•g-1•℃-1)。
(5)、若用1.1 g NaOH固体代替50 mL0.55 mol•L-1的NaOH溶液进行上述实验,放出的热量(填“偏大”“偏小”或“不变”)。20. 我国天然气储量丰富,天然气是重要的化工原料,先与氧气转化为合成气再进一步可催化转化为甲醇和二甲醚。回答下列问题:(1)、甲烷转化为合成气的反应中能量变化如图1所示,某些化学键的键能数据如表: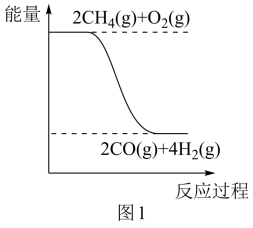
化学键
O=O
C-H
H-H
C≡O
键能/(kJ•mol-1)
498.8
413
436
1072
该反应的热化学方程式为。
(2)、CO和H2合成二甲醚的反应为2CO(g)+4H2(g)CH3OCH3(g)+H2O(g),T2℃时,向5L恒容密闭容器中充入1molCO(g)和2molH2(g),发生该反应,达到平衡时,测得容器内总压强为p,CO的体积分数为25%,则T2℃时,反应的平衡常数Kp=(用含p的代数式表示Kp , 分压=总压×物质的量分数)。(3)、CO和H2合成甲醇的反应为CO(g)+2H2(g)CH3OH(g) △H<0。若在容积可变的密闭容器中充入mmolCO和nmolH2 , (2m≠n)发生反应并达到平衡,CO的平衡转化率随温度(T)、压强(p)的变化曲线如图2所示。
①能判断该反应达到化学平衡状态的是(填标号)。
a.密度不再变化
b.H2的转化率和CO的转化率相等
c.混合气体的平均相对分子质量不再改变
②比较p1p2(填“>”“<”或“=”),理由。