安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题
试卷更新日期:2022-06-30 类型:期中考试
一、单选题
-
1. 中国国家主席习近平出席第七十六届联合国大会一般性辩论并发表重要讲话指出:“中国将力争2030年前实现碳达峰、2060年前实现碳中和,这需要付出艰苦努力,但我们会全力以赴。中国将大力支持发展中国家能源绿色低碳发展,不再新建境外煤电项目。”“碳中和”是指的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是( )A、将重质油裂解为轻质油作为燃料 B、大规模开采可燃冰作为新能源 C、通过清洁煤技术减少煤燃烧污染 D、研发催化剂将还原为甲醇2. 化学和生活密切相关,下列生产生活中实例不能用勒夏特列原理解释的是( )A、摇晃后的可乐开启后有大量气泡 B、合成氨工业中温度选择400-500℃ C、酸遇紫色石蕊试剂变红 D、生产硫酸的过程中用过量的空气和二氧化硫反应3. 灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。现把白锡制成的器皿放在0 ℃、100 kPa的室内存放,它会不会变成灰锡而不能再继续使用(已知:在0℃、100 kPa条件下白锡转化为灰锡的反应焓变和熵变分别为ΔH=-2.18k J·mol-1 , ΔS=-6.61 J·mol-1·K-1)( )A、会变成灰锡 B、不会变成灰锡 C、不能确定 D、升高温度才会变成灰锡4. 下列各组离子一定能在常温下指定环境中大量共存的是( )A、澄清溶液中:、、、 B、加入甲基橙显红色的溶液中:、、、 C、水电离出来的的溶液:、、、 D、的溶液:、、、5. 下列操作规范且能达到实验目的的是( )
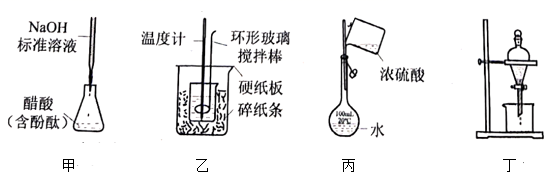 A、图甲测定醋酸浓度 B、图乙测定中和热 C、图丙稀释浓硫酸 D、图丁萃取分离碘水中的碘6. 2007年2月,中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( ).A、使用光催化剂不改变反应速率 B、使用光催化剂能增大NO的转化率 C、升高温度能加快反应速率 D、改变压强对反应速率无影响7. 向50mL溶液中加入足量稀硫酸充分反应后,放出2.56kJ的热量。向50mL稀盐酸溶液中加入足量充分反应后,放出1.1kJ的热量,则硫酸钠溶液与氯化钡溶液反应的热化学方程式为( )A、 B、 C、 D、8. 某同学想了解食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是指示剂的变色范围,叙述正确的是( )
A、图甲测定醋酸浓度 B、图乙测定中和热 C、图丙稀释浓硫酸 D、图丁萃取分离碘水中的碘6. 2007年2月,中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( ).A、使用光催化剂不改变反应速率 B、使用光催化剂能增大NO的转化率 C、升高温度能加快反应速率 D、改变压强对反应速率无影响7. 向50mL溶液中加入足量稀硫酸充分反应后,放出2.56kJ的热量。向50mL稀盐酸溶液中加入足量充分反应后,放出1.1kJ的热量,则硫酸钠溶液与氯化钡溶液反应的热化学方程式为( )A、 B、 C、 D、8. 某同学想了解食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是指示剂的变色范围,叙述正确的是( )指示剂
石蕊
甲基橙
甲基红
酚酞
变色范围(pH)
5.0~8.0
3.1~4.4
4.4~6.2
8.2~10.0
A、该实验应选用甲基橙作指示剂 B、盛装标准液的滴定管用蒸馏水洗涤过,未用标准液润洗会导致所测食醋中醋酸浓度偏大 C、用量筒量取一定体积的食醋溶液,用碱式滴定管量取一定体积的NaOH标准液 D、滴定时,眼睛一直注视着刻度线9. 已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥平衡常数一定增大
A、①② B、③⑤ C、②⑤ D、④⑥10. 布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是( ) A、布洛芬的分子式为 B、布洛芬与苯乙酸是同系物,都能和碳酸氢钠反应 C、1mol布洛芬最多能与3mol氢气发生加成反应 D、布洛芬在苯环上发生取代反应,其一氯代物有4种11. 将一定量的X加入某密闭容器中,发生反应: , 平衡时混合气体中X的物质的量分数与温度关系如图所示。下列推断正确的是( )
A、布洛芬的分子式为 B、布洛芬与苯乙酸是同系物,都能和碳酸氢钠反应 C、1mol布洛芬最多能与3mol氢气发生加成反应 D、布洛芬在苯环上发生取代反应,其一氯代物有4种11. 将一定量的X加入某密闭容器中,发生反应: , 平衡时混合气体中X的物质的量分数与温度关系如图所示。下列推断正确的是( ) A、平衡后加入高效催化剂可使混合气体的平均摩尔质量增大 B、压强大小有: C、升高温度,该反应平衡常数K减小 D、在该条件下M点X平衡转化率为12. 下列离子方程式的书写及评价均合理的是( )
A、平衡后加入高效催化剂可使混合气体的平均摩尔质量增大 B、压强大小有: C、升高温度,该反应平衡常数K减小 D、在该条件下M点X平衡转化率为12. 下列离子方程式的书写及评价均合理的是( )选项
离子方程式
评价
A
将1 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2
正确;Cl2过量,可将Fe2+、I-均氧化
B
Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2+++OH-= MgCO3↓+H2O
正确;酸式盐与碱反应生成正盐和水
C
过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+
正确;说明酸性:H2SO3强于HClO
D
1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合:2+5H+=Al3++Al(OH)3↓+H2O
正确;与Al(OH)3消耗的H+的物质的量之比为2∶3
A、A B、B C、C D、D13. 三甲胺N(CH3)3是重要的化工原料。我国科学家实现了在铜催化剂条件下将N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示(*表示物质吸附在铜催化剂上),下列说法正确的是( ) A、该历程中决速步骤为 B、该历程中的最大能垒(活化能)为2.16eV C、升高温度可以加快反应速率,并提高DMF的平衡转化率 D、若1molDMF完全转化为三甲胺,则会释放出1.02eV·NA的能量14. 常温下,pH均为2、体积均为的、、溶液,分别加水稀释至体积为V,溶液pH随的变化关系如图所示,下列叙述错误的是( )
A、该历程中决速步骤为 B、该历程中的最大能垒(活化能)为2.16eV C、升高温度可以加快反应速率,并提高DMF的平衡转化率 D、若1molDMF完全转化为三甲胺,则会释放出1.02eV·NA的能量14. 常温下,pH均为2、体积均为的、、溶液,分别加水稀释至体积为V,溶液pH随的变化关系如图所示,下列叙述错误的是( ) A、的电离度:a点<b点 B、当时,三种溶液同时升高温度,减小 C、当时,大于 D、是强酸,、是弱酸,且15. T℃,某密闭容器中发生: , 达到平衡后,下列说法正确的是( )A、该反应的化学平衡常数表达式为 B、加入CaO后,c(CO2)将减小 C、升高温度,该反应平衡将向正反应方向移动 D、将密闭容器体积缩小为原来一半,再次平衡后,CO2的浓度增大为原来2倍16. 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2 , 发生反应:2C(s)+2NO2(g)N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
A、的电离度:a点<b点 B、当时,三种溶液同时升高温度,减小 C、当时,大于 D、是强酸,、是弱酸,且15. T℃,某密闭容器中发生: , 达到平衡后,下列说法正确的是( )A、该反应的化学平衡常数表达式为 B、加入CaO后,c(CO2)将减小 C、升高温度,该反应平衡将向正反应方向移动 D、将密闭容器体积缩小为原来一半,再次平衡后,CO2的浓度增大为原来2倍16. 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2 , 发生反应:2C(s)+2NO2(g)N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
下列说法错误的是( )
A、T℃时,该反应的化学平衡常数为Kc=mol·L-1 B、由图可知,c点V正>V逆 C、向a点平衡体系中充入一定量的NO2 , 达到平衡时,NO2的转化率比原平衡小 D、容器内的压强:pa∶pb=6∶7二、综合题
-
17. 氮是一种重要的元素,含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:(1)、已知:
试写出表示氨气的标准燃烧热的热化学方程式:。
(2)、已知:合成尿素的反应为。向恒容密闭容器中按物质的量之比4∶1充入和 , 使反应进行,保持温度不变,测得的转化率随时间的变化情况如图所示。
①若用的浓度变化表示反应速率,则A点的逆反应速率B点的正反应速率(填“>”“<”或“=”)。
②下列叙述中不能说明该反应达到平衡状态的是(填选项字母)。
A.体系压强不再变化
B.气体平均摩尔质量不再变化
C.的消耗速率和的消耗速率之比为2∶1
D.固体质量不再发生变化
③工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有(填选项字母)。
A.升高温度B.加入催化剂
C.将尿素及时分离出去D.增大反应体系的压强
(3)、汽车尾气已成为许多大城市空气的主要污染源,其中存在大量。实验发现,易发生二聚反应并快速达到平衡。向真空钢瓶中充入一定量的进行反应,测得温度分别为和时的转化率随时间变化的结果如图所示。温度为时,达到平衡时体系的总压强为200kPa,X点的物质的量分数为(保留三位有效数字),X点对应的平衡常数(用分压表示,保留小数点后三位);提高平衡转化率的条件为(任写两点)。 18. 氯及其化合物在工业生产中具有很重要的作用。(1)、舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:。要想得到纯净干燥的氯气,一般先通入饱和的食盐水,然后再通入浓硫酸中。饱和食盐水的作用:①②降低氯气在水中的溶解度。试通过平衡移动的原理分析饱和食盐水降低氯气在水中的溶解度。原因是:。(2)、氯的化合物在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量 , 抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡固体加热时部分分解为、和 , T℃时平衡常数。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则kPa,反应的平衡常数。(3)、氯的许多化合物为疫情防控提供了强有力的物质支撑。已知:
18. 氯及其化合物在工业生产中具有很重要的作用。(1)、舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:。要想得到纯净干燥的氯气,一般先通入饱和的食盐水,然后再通入浓硫酸中。饱和食盐水的作用:①②降低氯气在水中的溶解度。试通过平衡移动的原理分析饱和食盐水降低氯气在水中的溶解度。原因是:。(2)、氯的化合物在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量 , 抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡固体加热时部分分解为、和 , T℃时平衡常数。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则kPa,反应的平衡常数。(3)、氯的许多化合物为疫情防控提供了强有力的物质支撑。已知:①次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数[ , X为或与pH的关系如图所示。的电离常数值为。

②常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为、、的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到溶液。上述过程中,生成的反应属于歧化反应,每生成1mol消耗的量为mol;产生“气泡”的化学方程式为。
③84消毒液的主要成分为和。已知25℃时,下列酸的电离平衡常数如下:
化学式
电离平衡常数
写出少量的通入84消毒液中的离子方程式:。
④二氯异氰尿酸钠是一种常用的消毒剂,具有很强的氧化性,对各种致病性微生物如病毒、细菌芽孢、真菌等有很强的杀生作用,是一种适用范围广,高效的杀菌剂,二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。
已知:实验检测原理为:
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量溶液,密封在暗处静置5min;用标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗溶液20.00mL。
滴定终点的现象是: , 该样品有效氯=。
19. 某研究性学习小组利用溶液和酸性溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:实验序号
实验温度/K
溶液颜色褪至无色所需时间/s
酸性溶液
溶液
A
293
2
0.02
4
0.1
0
B
2
0.02
3
0.1
8
C
313
2
0.02
0.1
1
(1)、通过实验A、B,可探究出(填外部因素)的改变对化学反应速率的影响,其中、 , 通过实验(填实验序号)可探究出温度变化对化学反应速率的影响,其中。(2)、若 , 则由此实验可以得出的结论是。忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用的浓度变化表示的反应速率。(3)、该小组的一位同学通过查阅资料发现,上述实验过程中随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对与草酸之间的反应有某种特殊作用,则该作用是。设计实验证明,分别取等体积等浓度的和混合,平均分成两份,一份中不加任何试剂,一份加入少量固体,观察到两溶液都没有褪色,原因是:。