人教【新课标】高中化学一轮复习:专题16物质结构与性质
试卷更新日期:2022-06-24 类型:一轮复习
一、单选题
-
1. 下列说法错误的是( )A、氢键、离子键和共价键都属于化学键 B、化学家门捷列夫编制了第一张元素周期表 C、药剂师和营养师必须具备化学相关专业知识 D、石灰石是制造玻璃和水泥的主要原料之一2. 下列化学用语表达正确的是( )A、基态硫原子的轨道表示式:
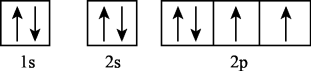 B、的电子式:
B、的电子式: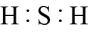 C、的VSEPR模型:
C、的VSEPR模型: D、的分子的空间结构模型
D、的分子的空间结构模型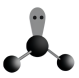 3. 下列说法正确的是( )A、分子形状呈三角锥形,是非极性分子 B、凡有规则外形的固体一定是晶体 C、电负性越大的元素,第一电离能也越大 D、分子中σ键与π键的数目之比是1:14. 下列有关化学用语表示正确的是( )A、次氯酸的电子式:
3. 下列说法正确的是( )A、分子形状呈三角锥形,是非极性分子 B、凡有规则外形的固体一定是晶体 C、电负性越大的元素,第一电离能也越大 D、分子中σ键与π键的数目之比是1:14. 下列有关化学用语表示正确的是( )A、次氯酸的电子式: B、的结构示意图:
B、的结构示意图: C、基态碳原子价层电子轨道表示式为:
C、基态碳原子价层电子轨道表示式为: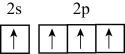 D、四氯化碳的空间填充模型:
D、四氯化碳的空间填充模型: 5. 下列表达方式错误的是( )A、H2O的电子式:
5. 下列表达方式错误的是( )A、H2O的电子式: B、基态Fe2+的价层电子排布式为:[Ar]3d44s2
C、基态S原子的结构示意图:
B、基态Fe2+的价层电子排布式为:[Ar]3d44s2
C、基态S原子的结构示意图: D、基态N原子的价层电子排布图:
D、基态N原子的价层电子排布图: 6. 有四种元素原子的基态或激发态原子的电子排布式如下:
6. 有四种元素原子的基态或激发态原子的电子排布式如下:① ② ③ ④
下列说法错误的是( )
A、元素①的一种单质可用于消毒杀菌 B、元素②所在周期中其原子半径最大 C、元素①③在周期表中位于第17列 D、元素④的简单氢化物常作制冷剂7. 下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )I1
I2
I3
I4
……
R
740
1500
7700
10500
……
①R的最高正价为+3价 ②R元素基态原子的电子排布式为1s22s2
③R元素第一电离能大于同周期相邻元素 ④R元素位于元素周期表中第ⅡA族
A、①② B、②③ C、③④ D、①④8. 下列分子中,中心原子的杂化方式和分子的空间构型均正确的是( )A、C2H4:sp、平面形 B、NH3:sp3、四面体 C、H2O:sp3、V形 D、CO2:sp2、直线形9. 实验室可用检验 , 离子方程式为。下列有关说法正确的是( )A、中铁离子的配位数为9 B、元素在周期表中位于第4周期ⅧB族,属区 C、中含键数目为 D、比更难再失去1个电子10. 下列粒子的中心原子的杂化轨道类型和粒子的空间结构错误的是( )A、中P原子为sp3杂化,分子空间结构为三角锥形 B、中O原子为sp杂化,分子空间结构为直线形 C、中N原子为sp3杂化,分子空间结构为正四面体形 D、中S原子为sp2杂化,分子空间结构为V形11. 一种碳化硅晶体的晶胞如图所示,与金刚石的类似。下列判断正确的是( ) A、该晶体质软 B、熔点:碳化硅>金刚石 C、该晶体熔融时会破坏极性键 D、碳原子轨道的杂化类型为sp杂化12. 2022年1月12日《自然》公布了我国科学家利用高温超导钇钡铜氧(YBCO)薄膜发现奇异金属。下列有关说法错误的是( )
A、该晶体质软 B、熔点:碳化硅>金刚石 C、该晶体熔融时会破坏极性键 D、碳原子轨道的杂化类型为sp杂化12. 2022年1月12日《自然》公布了我国科学家利用高温超导钇钡铜氧(YBCO)薄膜发现奇异金属。下列有关说法错误的是( ) A、金属晶体由金属离子和自由电子构成 B、氧化钡(BaO)晶体是离子晶体 C、基态Cu+的价层电子排布式为 D、如图所示晶胞代表的晶体的化学式为CuO13. 2021年4月16日,我国杰出青年曹原在《Science》发表了关于石墨烯研究的论文,再次引发世界关注,他的核心研究之一发现石墨烯的超导效应。石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体。其结构如图:有关说法正确的是( )
A、金属晶体由金属离子和自由电子构成 B、氧化钡(BaO)晶体是离子晶体 C、基态Cu+的价层电子排布式为 D、如图所示晶胞代表的晶体的化学式为CuO13. 2021年4月16日,我国杰出青年曹原在《Science》发表了关于石墨烯研究的论文,再次引发世界关注,他的核心研究之一发现石墨烯的超导效应。石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体。其结构如图:有关说法正确的是( ) A、12g石墨烯中含有1.5NA个C-C键 B、石墨烯中平均每个六元碳环含有3个碳原子 C、从石墨中剥离石墨烯需要破坏共价键 D、石墨烯中碳原子的杂化方式为sp3杂化14. 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为价。如图为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
A、12g石墨烯中含有1.5NA个C-C键 B、石墨烯中平均每个六元碳环含有3个碳原子 C、从石墨中剥离石墨烯需要破坏共价键 D、石墨烯中碳原子的杂化方式为sp3杂化14. 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为价。如图为超氧化钾晶体的一个晶胞,则下列说法正确的是( ) A、超氧化钾的化学式为 , 每个晶胞含有8个和4个 B、晶体中每个周围有8个 , 每个周围有8个 C、晶体中与每个距离最近的有8个 D、晶体中0价氧原子和价氧原子个数比为3∶115. 众多的配合物溶于水后易电离为配离子,但配离子难以进一步发生电离。+3价的钴形成的配合物为CoClm·nNH3 , 若中心原子配位数为6,1mol配合物与AgNO3溶液反应时最多可得到1mol沉淀物,则m、n的数值分别为( )A、1、5 B、5、1 C、3、4 D、3、516. 原子在形成分子时,、轨道和1个轨道参与形成杂化,的空间构型为三角双锥形(如下图所示)。下列关于分子的说法错误的是( )
A、超氧化钾的化学式为 , 每个晶胞含有8个和4个 B、晶体中每个周围有8个 , 每个周围有8个 C、晶体中与每个距离最近的有8个 D、晶体中0价氧原子和价氧原子个数比为3∶115. 众多的配合物溶于水后易电离为配离子,但配离子难以进一步发生电离。+3价的钴形成的配合物为CoClm·nNH3 , 若中心原子配位数为6,1mol配合物与AgNO3溶液反应时最多可得到1mol沉淀物,则m、n的数值分别为( )A、1、5 B、5、1 C、3、4 D、3、516. 原子在形成分子时,、轨道和1个轨道参与形成杂化,的空间构型为三角双锥形(如下图所示)。下列关于分子的说法错误的是( ) A、分子中价电子对数为5 B、分子中没有形成键 C、分子中所有的键角都相等 D、分子中原子也采用杂化
A、分子中价电子对数为5 B、分子中没有形成键 C、分子中所有的键角都相等 D、分子中原子也采用杂化二、综合题
-
17. 现有下列物质,用编号填空回答下列问题:
A.干冰 B.金刚石 C.氦 D.过氧化钠 E.二氧化硅 F.溴化铵 G. H2O2 H.氢氧化钠
(1)、通过非极性键形成的原子晶体是:。(2)、含有极性键的离子化合物是:。(3)、含有离子键、共价键、配位键的化合物是:。(4)、A,B,C,D四种物质的熔点从低到高的顺序为。18. 2019年1月,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆:也首次实现了我国地外天体采样返回;所搭载的“玉兔二号”月球车,通过砷化镓()太阳能电池提供能量进行工作。带回的月壤中包含了等多种元素。回答下列问题:(1)、基态最高能层中成对电子与未成对电子的数目之比为。(2)、的熔点为1238℃且熔融状态不导电,据此判断它是(填“共价”或“离子”)化合物。(3)、H和O可以形成和。是(填“极性”或“非极性”)分子。(4)、砷化镓可由和在制得,中碳原子的杂化方式为。(5)、S与O可形成多种酸根离子及化合物,如、、、等,其中的模型是;的空间构型为。(6)、催化烯烃硝化反应过程中会产生。键角:(填“>”或“<”)。19. 向少量0.05mol/LFe2(SO4)3溶液中滴加1滴0.1mol/LKSCN溶液,可发生如下反应: , 这一系列配离子的颜色从吸收峰的波长来看是相近的,以下是其中一种配离子的结构。(1)、这一系列配离子的中心离子的核外电子的空间运动状态有种。(2)、如图所示的配离子的中心离子的配位数是。 (3)、第一电离能I1(K)I1(Fe)(填“大于”或“小于”),原因是。(4)、关于这一系列配离子所含元素及其化合物的说法,下列正确的有____。A、沸点由高到低顺序为H2S>CH4>NH3 B、键角由大到小顺序为CH4>NH3>H2S C、碳和硫的氧化物都是极性分子 D、碳的电负性比氮强(5)、Fe2(SO4)3固体的晶体类型为 , 其阴离子的空间构型为。(6)、图1是KSCN晶胞图,图2是该晶胞的正视图,图3是该晶胞的侧视图,设阿伏加德罗常数的值为NA , 则KSCN晶体的密度是(列出计算表达式),图1中ABCD四个原子构成的图形是。
(3)、第一电离能I1(K)I1(Fe)(填“大于”或“小于”),原因是。(4)、关于这一系列配离子所含元素及其化合物的说法,下列正确的有____。A、沸点由高到低顺序为H2S>CH4>NH3 B、键角由大到小顺序为CH4>NH3>H2S C、碳和硫的氧化物都是极性分子 D、碳的电负性比氮强(5)、Fe2(SO4)3固体的晶体类型为 , 其阴离子的空间构型为。(6)、图1是KSCN晶胞图,图2是该晶胞的正视图,图3是该晶胞的侧视图,设阿伏加德罗常数的值为NA , 则KSCN晶体的密度是(列出计算表达式),图1中ABCD四个原子构成的图形是。 20. 【化学—选修3:物质结构与性质】
20. 【化学—选修3:物质结构与性质】2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:
(1)、基态F原子的价电子排布图(轨道表示式)为。(2)、图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是(填标号),判断的根据是;第三电离能的变化图是(填标号)。 (3)、固态氟化氢中存在(HF)a形式,画出(HF)3的链状结构。(4)、CH2=CH2和ETEFE分子中C的杂化轨道类型分别为和;聚四氟乙烯的化学稳定性高于聚乙烯,从化学健的角度解释原因。(5)、萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是;若该立方晶胞参数为apm,正负离子的核间距最小为pm。
(3)、固态氟化氢中存在(HF)a形式,画出(HF)3的链状结构。(4)、CH2=CH2和ETEFE分子中C的杂化轨道类型分别为和;聚四氟乙烯的化学稳定性高于聚乙烯,从化学健的角度解释原因。(5)、萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是;若该立方晶胞参数为apm,正负离子的核间距最小为pm。