人教【新课标】高中化学一轮复习:专题15实验设计与评价
试卷更新日期:2022-06-24 类型:一轮复习
一、单选题
-
1. 实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
 A、①是氨气发生和干燥装置 B、②是氨气吸收装置 C、③是氨气发生装置 D、④是氨气收集、检验装置2. 下列实验装置不能达到相应实验目的的是( )
A、①是氨气发生和干燥装置 B、②是氨气吸收装置 C、③是氨气发生装置 D、④是氨气收集、检验装置2. 下列实验装置不能达到相应实验目的的是( ) A、用甲装置验证钠和氯气能反应 B、用乙装置验证石蜡油分解的产物中含有不饱和烃 C、用丙装置验证甲烷和氯气能发生反应 D、用丁装置制备并收集氨气3. 下列实验装置正确且能达到实验目的的是( )
A、用甲装置验证钠和氯气能反应 B、用乙装置验证石蜡油分解的产物中含有不饱和烃 C、用丙装置验证甲烷和氯气能发生反应 D、用丁装置制备并收集氨气3. 下列实验装置正确且能达到实验目的的是( )A
B
C
D
实验目的
实验室制乙酸乙酯
蒸干溶液制无水
苯萃取碘水中的 , 分出水层后的操作
比较碳酸与苯酚酸性强弱
实验装置



 A、A B、B C、C D、D4. 下列关于实验现象的解释或所得结论正确的是( )
A、A B、B C、C D、D4. 下列关于实验现象的解释或所得结论正确的是( )选项
实验操作
现象
解释或所得结论
A
向某无色溶液中滴加盐酸酸化的BaCl2溶液
产生白色沉淀
该无色溶液中含有SO
B
用pH计分别测定相同浓度的Na2S和NaCl溶液的pH
Na2S溶液的pH较大
Cl的非金属性强于S
C
将pH=3的醋酸溶液稀释到原体积的100倍再测其pH
3<pH<5
醋酸是弱酸
D
将久置于空气中的NaOH固体溶于水,向其中加入BaCl2溶液
有白色沉淀生成
该NaOH固体已完全变质
A、A B、B C、C D、D5. 用下列装置进行实验(部分夹持仪器已省略),不能达到实验目的的是( ) A、用甲装置制备并收集NH3 B、用乙装置进行NH3的喷泉实验 C、用丙装置制取少量乙酸乙酯 D、用丁装置制取氢氧化亚铁6. 下图是实验室制取二氧化硫并验证其部分性质的装置,下列说法错误的是( )
A、用甲装置制备并收集NH3 B、用乙装置进行NH3的喷泉实验 C、用丙装置制取少量乙酸乙酯 D、用丁装置制取氢氧化亚铁6. 下图是实验室制取二氧化硫并验证其部分性质的装置,下列说法错误的是( ) A、甲装置中,使用70%的浓硫酸既可以加快反应速率又有利于生成的逸出 B、乙装置中使用品红溶液是用来验证的漂白性 C、丙装置中使用酸性溶液是用来验证的还原性 D、丁装置中过量的氨水吸收气体可以生成亚硫酸氢铵7. 下列气体的制备和性质实验中,由现象得出的结论错误的是( )
A、甲装置中,使用70%的浓硫酸既可以加快反应速率又有利于生成的逸出 B、乙装置中使用品红溶液是用来验证的漂白性 C、丙装置中使用酸性溶液是用来验证的还原性 D、丁装置中过量的氨水吸收气体可以生成亚硫酸氢铵7. 下列气体的制备和性质实验中,由现象得出的结论错误的是( )选项
试剂
试纸或试液
现象
结论
A
浓盐酸、浓硫酸
湿润的pH试纸
变红
HCl为酸性气体
B
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
C
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3溶于水显碱性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
A、A B、B C、C D、D8. 下列实验方案正确且能达到实验目的的是( )选项
实验方案
实验目的
A
用少量NaOH溶液洗涤乙酸乙酯粗品
除去粗品中的乙酸
B
用排水法收集铜与稀硝酸反应生成的气体
收集NO
C
将FeCl3·6H2O溶于热水中,然后冷却稀释
配制FeCl3溶液
D
将可能含有乙烯的SO2气体通入溴水中
验证气体中含有乙烯
A、A B、B C、C D、D9. 检验下列溶液是否变质,所选试剂合理的是( )选项
A
B
C
D
溶液
Na2SO3溶液.
FeSO4溶液
KI溶液
NaOH溶液
所选试剂
BaCl2溶液
KSCN溶液
AgNO3溶液
高锰酸钾溶液
A、A B、B C、C D、D10. 下列有关物质检验的实验操作、现象及结论均正确的是( )选项
实验操作及现象
实验结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO
B
向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色
该溶液中一定含有Fe2+
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定为SO2
D
向某溶液中加入氢氧化钠溶液并加热,产生有刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红
该溶液中一定含有NH
A、A B、B C、C D、D11. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
实验结论
A
向同体积同浓度的H2O2溶液中,分别加入1mol·L-1的氯化铜和氯化铁溶液,加氯化铁溶液的H2O2分解的快
铁离子对H2O2分解速率的影响比铜离子大
B
向饱和Na2CO3溶液中通入足量CO2 , 溶液变浑浊
析出了NaHCO3
C
向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热,得到蓝色溶液
蔗糖水解产物没有还原性
D
向NaCl和NaBr的混合溶液中滴入少量AgNO3溶液,产生淡黄色沉淀(AgBr)
Ksp(AgBr)<Ksp (AgCl)
A、A B、B C、C D、D12. 下列实验的实验操作、实验现象和实验结论都正确的是( )选项
实验操作
实验现象
实验结论
A
室温下,向铝箔上滴加浓硫酸
无明显现象
铝与浓硫酸不反应
B
将二氧化硫通入紫色石蕊试液
先变红后褪色
二氧化硫是酸性氧化物,还具有漂白性
C
在氯化银悬浊液中滴加少量KBr稀溶液
白色浑浊变为淡黄色浑浊
Ksp(AgCl)>Ksp (AgBr)
D
NaAlO2溶液中滴加 NaHCO3溶液
产生白色沉淀
N aAlO2和Na HCO3发生相互促进的水解反应
A、A B、B C、C D、D13. 下列实验操作、实验现象、解释或结论不对应的是( )选项
实验操作
实验现象
解释或结论
A
将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近
产生大量白烟
氨气与氯化氢反应生成固体物质
B
常温下,将洁净的铁片放入浓硫酸或浓硝酸中
无明显变化
常温下,浓硫酸、浓硝酸使铁片钝化
C
在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中
产生苍白色火焰
物质燃烧不一定需要氧气
D
向某无色溶液中滴加盐酸
产生能使澄清石灰水变浑浊气体
说明溶液中一定含有CO32-
A、A B、B C、C D、D14. 亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是( )方案设计
现象和结论
A
先加入少量KClO3溶液,再加溶液和足量稀硝酸,振荡
若产生白色沉淀,则样品为亚硝酸钠
B
加到少量溶液中,再加硫酸酸化,振荡
若溶液褪色,则样品为亚硝酸钠
C
先加到少量溶液中,再加入稀盐酸酸化,振荡
若溶液变黄色,则样品为亚硝酸钠
D
先加入少量溶液,再加入溶液和稀硝酸,振荡
若产生白色沉淀,则样品为亚硝酸钠
A、A B、B C、C D、D15. 为探究 的性质,进行了如下实验( 和 溶液浓度均为 )。实验
操作与现象
①
在 水中滴加2滴 溶液,呈棕黄色;煮沸,溶液变红褐色。
②
在 溶液中滴加2滴 溶液,变红褐色;
再滴加 溶液,产生蓝色沉淀。
③
在 溶液中滴加2滴 溶液,变红褐色;
将上述混合液分成两份,一份滴加 溶液,无蓝色沉淀生成;
另一份煮沸,产生红褐色沉淀。
依据上述实验现象,结论不合理的是( )
A、实验①说明加热促进 水解反应 B、实验②说明 既发生了水解反应,又发生了还原反应 C、实验③说明 发生了水解反应,但没有发生还原反应 D、整个实验说明 对 的水解反应无影响,但对还原反应有影响16. 下列实验设计能达实验目的的是( )选项
实验目的
实验设计
A
除去CH4中的CH2=CH2
气体依次通过盛有高锰酸钾溶液、浓硫酸的洗气瓶
B
测定次氯酸钠溶液的pH
将待测液滴在湿润的pH试纸上,再与标准比色卡对照
C
探究浓度对化学反应速率的影响
取大小、形状、质量相同的Cu粒分别投入稀硝酸和浓硝酸中
D
制取H2
向稀硫酸中加入Zn和少量Cu单质
A、A B、B C、C D、D二、综合题
-
17. 二草酸合铜(Ⅱ)酸钾()可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的溶液,搅拌下滴加足量溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸()溶液中加入适量固体,制得和混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)、由配制Ⅰ中的溶液,下列仪器中不需要的是(填仪器名称)。 (2)、长期存放的中,会出现少量白色固体,原因是。(3)、Ⅰ中的黑色沉淀是(写化学式)。(4)、Ⅱ中原料配比为 , 写出反应的化学方程式。(5)、Ⅱ中,为防止反应过于剧烈而引起喷溅,加入应采取的方法。(6)、Ⅲ中应采用进行加热。(7)、Ⅳ中“一系列操作”包括。18. 用如图所示装置可检验混合气体中同时含有SO2和CO2。
(2)、长期存放的中,会出现少量白色固体,原因是。(3)、Ⅰ中的黑色沉淀是(写化学式)。(4)、Ⅱ中原料配比为 , 写出反应的化学方程式。(5)、Ⅱ中,为防止反应过于剧烈而引起喷溅,加入应采取的方法。(6)、Ⅲ中应采用进行加热。(7)、Ⅳ中“一系列操作”包括。18. 用如图所示装置可检验混合气体中同时含有SO2和CO2。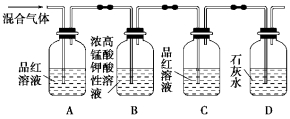 (1)、能够证明混合气体中含有SO2的实验现象是:;(2)、设计B、C的实验目的是:;(3)、写出B中发生反应的离子方程式:;(4)、能够证明混合气体中含有CO2的实验现象是: 。(5)、若将等体积的SO2和Cl2一起通入水中,写出所发生反应的化学方程式。19. 无水三氯化铁常用于净水剂、印染的媒染剂,印刷制版时的腐蚀剂,在化学工业中还可制造其他铁盐,及处理肥皂提取粗甘油等。实验室用铁粉与氯气反应制备无水FeCl3的实验装置如图所示((夹持装置已省略),已知: FeCl3具有易水解、 易升华的性质
(1)、能够证明混合气体中含有SO2的实验现象是:;(2)、设计B、C的实验目的是:;(3)、写出B中发生反应的离子方程式:;(4)、能够证明混合气体中含有CO2的实验现象是: 。(5)、若将等体积的SO2和Cl2一起通入水中,写出所发生反应的化学方程式。19. 无水三氯化铁常用于净水剂、印染的媒染剂,印刷制版时的腐蚀剂,在化学工业中还可制造其他铁盐,及处理肥皂提取粗甘油等。实验室用铁粉与氯气反应制备无水FeCl3的实验装置如图所示((夹持装置已省略),已知: FeCl3具有易水解、 易升华的性质 (1)、A的作用是 , 仪器G的名称为。(2)、请写出装置C中发生反应的化学方程式:。(3)、在D、F处收集产物是利用了FeCl3的性质:实验过程中若E处出现堵塞,则在B处可观察到的现象是。(4)、装置G的作用是。装置H中发生反应的离子方程式是。(5)、某同学用11.2g 干燥铁粉制得无水FeCl3样品29.9g,该次实验的产率是。20. 硫化钠可广泛用于染料、医药行业.工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质.硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列向题:(1)、工业上常用芒硝()和煤粉在高温下生产硫化钠,同时生成 , 该反应的化学方程式为。(2)、溶解回流装置如图所示,回流前无需加入沸石,其原因是。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3。若气雾上升过高,可采取的措施是。
(1)、A的作用是 , 仪器G的名称为。(2)、请写出装置C中发生反应的化学方程式:。(3)、在D、F处收集产物是利用了FeCl3的性质:实验过程中若E处出现堵塞,则在B处可观察到的现象是。(4)、装置G的作用是。装置H中发生反应的离子方程式是。(5)、某同学用11.2g 干燥铁粉制得无水FeCl3样品29.9g,该次实验的产率是。20. 硫化钠可广泛用于染料、医药行业.工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质.硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列向题:(1)、工业上常用芒硝()和煤粉在高温下生产硫化钠,同时生成 , 该反应的化学方程式为。(2)、溶解回流装置如图所示,回流前无需加入沸石,其原因是。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3。若气雾上升过高,可采取的措施是。 (3)、回流时间不宜过长,原因是。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为(填标号)。
(3)、回流时间不宜过长,原因是。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为(填标号)。
A. ①②③ B.③①② C.②①③ D.①③②(4)、该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是。过滤除去的杂质为。若滤纸上析出大量晶体,则可能的原因是。(5)、滤液冷却、结晶、过滤,晶体用少量洗涤,干燥,得到。21. 以MnO2粉(含少量Fe3O4、CaO、MgO等杂质)和MnS(溶于酸,不溶于水)为原料制备MnSO4·H2O的过程如下:(1)、反应:将一定量MnO2粉和稀硫酸加入到如图所示实验装置的三颈烧瓶中,加热到90℃后开始加入MnS,并不断搅拌,充分反应。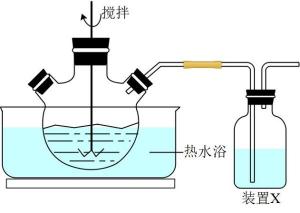
①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为。
②装置X中是NaOH溶液,作用是。
(2)、除杂。查阅资料可知:Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11 , Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
Fe(OH)2
Fe(OH)3
Mn(OH)2
开始沉淀pH
7.6
1.5
8.3
沉淀完全pH
9.7
3.2
9.8
①将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。

Mg2+去除率曲线为(填写“甲”或“乙”)。随pH减小,钙镁去除率下降的原因是。
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案: , 控制温度在80~90℃之间蒸发结晶至有大量晶体出现,趁热过滤,用80~90℃的蒸馏水洗涤2~3次,干燥。(可选用的试剂:H2O2溶液、MnCO3固体、Na2CO3固体、蒸馏水等)。
(3)、测定。准确称取0.3850 g MnSO4·H2O样品置于锥形瓶中,加入H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+ , 用0.1000 mol·L-1硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗标准溶液20.00 mL。计算MnSO4·H2O样品的纯度(请写出计算过程)。