人教【新课标】高中化学一轮复习:专题14物质的分离、提纯与检验
试卷更新日期:2022-06-24 类型:一轮复习
一、单选题
-
1. 豆浆营养丰富,是大众喜爱的传统饮品。下列制作豆浆的主要步骤中,属于过滤的是( )A、泡豆
 B、磨豆
B、磨豆 C、沥浆
C、沥浆 D、煮浆
D、煮浆 2. 下列基本实验操作正确的是( )
2. 下列基本实验操作正确的是( )



A.过滤
B.分液
C.蒸馏
D.蒸发
A、A B、B C、C D、D3. 某白色粉末样品,可能含有、、和 . 取少量样品进行如下实验:①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出.离心分离.
③取②的上层清液,向其中滴加溶液有沉淀生成.
该样品中确定存在的是( )
A、 B、 C、 D、4. 实验室进行粗盐提纯时,需除去 和 ,所用试剂包括 以及( )A、 B、 C、 D、5. 实验室中对下列气体洗气除杂的方法可行的是( )气体(杂质)
通过除杂试剂
A
C2H4(SO2)
酸性高锰酸钾溶液
B
NH3(H2O)
无水氯化钙
C
Cl2(HCl)
饱和食盐水
D
NO(HCl)
饱和NaHCO3溶液
A、A B、B C、C D、D6. 下列气体去除杂质的方法中,达不到实验目的的是( )选项
气体(杂质)
方法
A
Cl2(HCl)
通过饱和的食盐水
B
N2(O2)
通过足量灼热的铜丝网
C
SO2(CO2)
通过饱和的碳酸氢钠溶液
D
NH3(H2O)
通过盛有碱石灰的干燥管
A、A B、B C、C D、D7. 下列实验操作能达到目的的是( )实验目的
实验操作
A
除去乙烷中的乙烯
将混合气体通入酸性高锰酸钾溶液
B
除去乙醇中的水
加入生石灰,蒸馏
C
鉴别苯和环己烷
加入溴水振荡,静置后观察分层及颜色差异
D
分离苯和溴苯
加水后分液
A、A B、B C、C D、D8. 只用括号内试剂不能鉴别下列各组内物质的是( )A、甲苯、己烯、溴苯、乙酸(溴水) B、硝基苯、苯酚钠、溶液、乙醇溶液(盐酸) C、苯、甲苯、甲醛溶液、苯酚溶液(酸性溶液) D、乙醇、乙酸、乙酸乙酯、葡萄糖溶液(新制悬浊液)9. 为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是( )选项
混合物
除杂试剂
分离方法
A
苯(苯酚)
浓溴水
过滤
B
溴苯(溴)
NaOH溶液
分液
C
甲烷(乙烯)
酸性KMnO4溶液
洗气
D
乙酸乙酯(乙酸)
氢氧化钠溶液
蒸馏
A、A B、B C、C D、D10. 检验下列指定成分所用的试剂正确的是( )选项
检验括号中的物质
检验试剂
A
CO2气体(H2S)
CuSO4溶液
B
Na2SO3溶液(Na2SO4)
BaCl2溶液
C
海水(KI)
淀粉溶液
D
乙醇(水)
金属钠
A、A B、B C、C D、D11. 下列物质除杂的过程中,不能实现目的的是( )原物(杂质)
除杂试剂
除杂方法
A
CO2(H2S)
CuSO4溶液
洗气
B
碳粉(MnO2)
浓盐酸
加热后过滤
C
乙酸(乙醇)
饱和Na2CO3溶液
蒸馏
D
硝基苯(NO2)
NaOH溶液
分液
A、A B、B C、C D、D12. 下列除去杂质的试剂及其方法正确的是(括号内为杂质)( )选项
含杂质物质
除杂试剂
方法
A
乙烷(乙烯)
溴水;浓硫酸
洗气
B
品红溶液;NaOH溶液
洗气
C
乙酸乙酯(乙酸)
乙醇;浓硫酸
加热、分液
D
Fe(Cu)
稀硫酸
过滤、洗涤、干燥
A、A B、B C、C D、D13. 为了提纯表中所列物质(括号内为杂质),有关除杂试剂和分离方法的选择错误的是( )选项
被提纯的物质
除杂试剂
分离方法
A
己烷(己烯)
溴水
分液
B
苯甲酸(NaCl)
水
重结晶
C
溴苯(溴)
NaOH溶液
分液
D
乙炔(H2S)
CuSO4溶液
洗气
A、A B、B C、C D、D14. 分离提纯是化学学科的基本实验操作。下列为达到实验目的所使用的分离提纯方法不正确的是( )选项
实验目的
方法
A
分离固体碘和固体氯化铵
加热
B
从自来水中获得蒸馏水
蒸馏
C
除去粗盐中的泥沙
过滤
D
从溴水中提取溴
萃取
A、A B、B C、C D、D15. 从海带中提取碘的一种实验流程如图所示,下列说法错误的是( ) A、灼烧海带可在坩埚中进行 B、操作①为加水浸泡、过滤、洗涤残渣 C、反应②中发生的主要反应为 D、试剂③可以选用无水乙醇16. 工业上用铝土矿(主要成分为Al2O3 , 杂质为Fe2O3、SiO2)提取Al2O3做冶炼铝的原料,提取的操作过程如图:
A、灼烧海带可在坩埚中进行 B、操作①为加水浸泡、过滤、洗涤残渣 C、反应②中发生的主要反应为 D、试剂③可以选用无水乙醇16. 工业上用铝土矿(主要成分为Al2O3 , 杂质为Fe2O3、SiO2)提取Al2O3做冶炼铝的原料,提取的操作过程如图:
下列说法错误的是( )
A、操作1、2、3均为过滤,固体1的主要成分为SiO2 B、固体2为红褐色固体 C、步骤③的离子方程式为2[Al(OH)4]-+CO2=2Al(OH)3↓+CO+H2O D、Al2O3为离子化合物,其熔点高17. 实验室以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料,制备NixOy和CoCO3的工艺流程如图所示。
已知:25℃时,Ksp[Co(OH)2]=2.0×10-15.下列说法正确的是( )
A、滤渣I中含H2SiO3和BaSO4 B、“氧化”、“调pH”时均需加过量的试剂 C、“萃取”时,待下层液体从分液漏斗下口流出后,上层液体再从下口放出 D、“沉钴”开始时,若溶液中的c(Co2+)=0.02mol·L-1 , 为防止生成Co(OH)2 , 应控制溶液pH<7.518. 是一种常见的化肥,某工厂用石膏、制备的工艺流程如下:
下列说法正确的是( )
A、步骤②中反应的离子方程式为 B、操作1是过滤、操作2是蒸馏 C、通入的和均应过量,且工业流程中可循环利用 D、通入和的顺序可以颠倒二、综合题
-
19. 菜之魂在味,在“七味八滋”中,盐应是百味之首。粗盐常含有少量 、 、 以及泥沙等杂质,实验室中提纯 的流程如图所示。

回答下列问题:
(1)、操作Ⅰ需要使用的玻璃仪器是(填仪器名称)。(2)、操作Ⅱ为蒸发结晶,蒸发过程中时停止加热。(3)、溶液a和溶液b分别为溶液和溶液,加入过量溶液b的目的是(用离子方程式表示)。(4)、说明溶液c已经足量的现象为。(5)、称取 精盐,配制成 溶液;量取 与 的 溶液反应,消耗 溶液的体积为 ,则该精盐样品中 的质量分数是。20. 山西运城实施“盐湖‘全科’修复,生态蝶变‘提速’”工程,“五步制盐”古老工艺将传承再现。模拟“五步制盐法”制备粗盐(主要成分 , 还含有以及泥沙等杂质),并进一步在实验室中制备精盐的流程如下。 (1)、加入过量溶液时发生反应的离子方程式为。(2)、试剂A是 , 加入它的目的是。(3)、操作X的名称是 , 这一操作类似于“五步制盐法”中的。(4)、加入适量稀盐酸的目的是。(5)、操作Y中所用的陶瓷仪器是。21. 从印刷电路板的腐蚀废液(主要含CuCl2、FeCl3、FeCl2等)中回收FeCl3、制备CuSO4·5H2O的流程如下。
(1)、加入过量溶液时发生反应的离子方程式为。(2)、试剂A是 , 加入它的目的是。(3)、操作X的名称是 , 这一操作类似于“五步制盐法”中的。(4)、加入适量稀盐酸的目的是。(5)、操作Y中所用的陶瓷仪器是。21. 从印刷电路板的腐蚀废液(主要含CuCl2、FeCl3、FeCl2等)中回收FeCl3、制备CuSO4·5H2O的流程如下。 (1)、上述流程中能加快反应速率的措施有。(2)、粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:
(1)、上述流程中能加快反应速率的措施有。(2)、粗品的主要成分是硫酸铜晶体,而不是硝酸铜晶体,分析有两种可能的原因:①相对于Cu2+ , 粗液中浓度过小,原因是(用离子方程式表示),不能得到硝酸铜晶体。
②粗液中浓度较大,但由于 , 不能得到硝酸铜晶体。
(3)、测量粗品中铁(含、)的含量,评定纯度等级。Ⅰ.用水溶解一定质量粗品,加入稀和溶液,加热。
Ⅱ.待溶液冷却后,加入试剂X至溶液。过滤、洗涤,得到红褐色沉淀。
Ⅲ.用稀溶解红褐色沉淀,滴入溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
已知:完全沉淀的pH为6.7,完全沉淀的pH为2.8
①Ⅰ中将氧化为的离子方程式是。
②试剂X是。
(4)、电解:在不同电压、不同pH(pH<7)条件下电解溶液,研究溶液的再生条件。序号
电压
阴极现象
阳极产物
i
a
无气泡,少量金属析出
无 , 有
ii
b
较多气泡,极少量金属析出
无 , 有
iii
a
少量气泡,少量金属析出,
有 , 有
( , )
①iii中产生的原因有、。
②溶液再生的合适条件是(填实验序号)。
22. 金属镓拥有电子工业脊梁的美誉,镓与铝同族,化学性质相似。一种从高铝粉煤灰(主要成分是Al2O3 , 还含有少量Ga2O3和Fe2O3等)中回收镓的工艺如下:
回答下列问题:
(1)、“焙烧”中,Ga2O3转化成NaGaO2的化学方程式为。(2)、“碱浸”所得浸出渣的主要成分是。(3)、“转化1”中通入过量CO2至溶液pH=8,过滤,所得滤渣的主要成分是Al(OH)3和Ga(OH)3 , 写出生成Al(OH)3的离子方程式。(4)、“溶镓”所得溶液中存在的阴离子主要有。(5)、“电解”所用装置如图所示,阴极的电极反应为。若电解获得1molGa,则阳极产生的气体在标准状况下的体积至少为L,电解后,阳极室所得溶液中的溶质经加热分解生成(填化学式)可循环利用。 23. 钛合金是一种重要的航空材料,以下是以钛铁矿(主要成分为FeTiO3 , 含FeO和Fe2O3等杂质)为原料制备金属钛及副产品铁红的工艺流程:
23. 钛合金是一种重要的航空材料,以下是以钛铁矿(主要成分为FeTiO3 , 含FeO和Fe2O3等杂质)为原料制备金属钛及副产品铁红的工艺流程: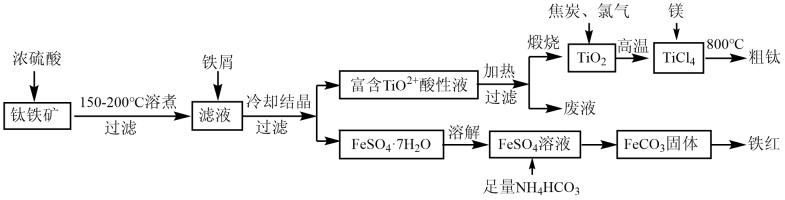
已知:①TiO2+易水解为TiO2·nH2O;高温下钛易与N2、H2等反应。
②常温下,Ksp [Fe(OH)2]=8.0×10-16 , Ksp[FeCO3]=3.2×10-11。
回答下列问题:
(1)、钛铁矿溶煮前需要粉碎,其目的是 。(2)、在“滤液”中加入铁屑的作用是 。(3)、FeSO4溶液中加入NH4HCO3时还有气体放出,写出反应的化学方程式: ,该反应温度不宜过高,原因是 。(4)、制备FeCO3时,若将NH4HCO3换成(NH4)2CO3 , 还会产生Fe(OH)2,原因可能是:FeCO3+2OH-→Fe(OH)2+CO , 计算该反应的平衡常数K=。(5)、“富含TiO2+酸性液”加热并过滤后,所得“废液”中溶质的主要成分是 。(6)、已知TiO2(s)+2Cl2(g)→TiCl4(1)+O2(g) ΔH=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生,从化学平衡的角度解释原因为 。(7)、镁与TiCl,高温下反应制备粗钛时需加保护气,下列可作为保护气的是____(填标号)。A、H2 B、Ar C、CO2 D、N224. 废镍催化剂主要含Ni,还有少量Cu、Fe、Al及其氧化物、。某研究性学习小组设计如下工艺流程回收镍,制备硫酸镍晶体。
该小组同学查阅资料知:
①镍的化学性质与铁相似,能与酸缓慢反应。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
开始沉淀时的pH
7.2
3.7
2.2
7.5
沉淀完全时的pH
8.7
4.7
3.2
9.0
(1)、除“粉碎”外,请你再写出一条提高废镍催化剂酸浸效率的措施。(2)、滤渣1的主要成分有。(3)、实验室中进行操作A所用的主要玻璃仪器有。(4)、“溶液”中加入目的是(用离子方程式表示)。有同学认为可用NaClO代替 , 你认为此方案是否可行? (填“是”或“否”),理由是。(5)、下列物质调溶液pH,最好选用(填字母标号)。a.氨水 b.稀 c. d.
若调pH前 , 和浓度均为 , 则“调pH”需控制溶液pH的范围为。
(6)、如图为的溶解度随温度变化关系,据图分析操作B是。