人教【新课标】高中化学一轮复习:专题12电化学
试卷更新日期:2022-06-24 类型:一轮复习
一、单选题
-
1. 下列关于原电池的叙述正确的是( )A、构成原电池的正极和负极的材料必须是两种不同的金属 B、原电池是将化学能转化为电能的装置 C、在原电池中,电子流出的一极是正极 D、原电池工作时,电路中的电流是从负极到正极2. 下列各装置能构成原电池的是( )A、
 B、
B、 C、
C、 D、
D、 3. 某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是( )
3. 某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是( )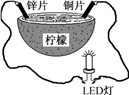 A、将电能转化为化学能 B、电子由锌片经导线流向铜片 C、铜片作负极 D、锌片发生还原反应4. 某兴趣小组以相同大小的铜片和锌片为电极研究水果电池,装置如下图。当电池工作时,下列说法错误的是( )
A、将电能转化为化学能 B、电子由锌片经导线流向铜片 C、铜片作负极 D、锌片发生还原反应4. 某兴趣小组以相同大小的铜片和锌片为电极研究水果电池,装置如下图。当电池工作时,下列说法错误的是( ) A、铜片为正极 B、负极的电极反应为Zn-2e-=Zn2+ C、化学能主要转化为电能 D、电子从锌片经水果流向铜片5. 用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A、铜片为正极 B、负极的电极反应为Zn-2e-=Zn2+ C、化学能主要转化为电能 D、电子从锌片经水果流向铜片5. 用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( ) A、电子通过盐桥从乙池移向甲池 B、盐桥中K+向左移动 C、开始时,银片上发生的反应是Ag-e-=Ag+ D、电路中每转移2mole- , 正极材料增重216g6. 如图为一种氢氧燃料电池的装置示意图,下列说法错误的是( )
A、电子通过盐桥从乙池移向甲池 B、盐桥中K+向左移动 C、开始时,银片上发生的反应是Ag-e-=Ag+ D、电路中每转移2mole- , 正极材料增重216g6. 如图为一种氢氧燃料电池的装置示意图,下列说法错误的是( ) A、该装置中氧化反应和还原反应在不同区域进行 B、石墨是电极材料 C、O2是正极反应物、H2是负极反应物 D、H2SO4可以传导电子和离子7. 科学家设计了锂-空气电池,它直接使用金属锂作负极,让从空气中获得的通过多孔碳电极。该电池具有较高的能量密度(单位质量的电池所放出的能量)。下列关于这种电池的说法正确的是( )A、放电时氧气发生氧化反应 B、放电时电子向负极移动 C、放电时电能转化为化学能 D、能量密度高可能是因为锂的相对原子质量小8. 镉镍可充电电池的充、放电反应如下:Cd + 2NiO(OH) + 2H2OCd(OH)2 + 2Ni(OH)2。则该电池充电时阳极放电的是( )A、Cd(OH)2 B、Cd C、Ni(OH)2 D、NiO(OH)9. 下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
A、该装置中氧化反应和还原反应在不同区域进行 B、石墨是电极材料 C、O2是正极反应物、H2是负极反应物 D、H2SO4可以传导电子和离子7. 科学家设计了锂-空气电池,它直接使用金属锂作负极,让从空气中获得的通过多孔碳电极。该电池具有较高的能量密度(单位质量的电池所放出的能量)。下列关于这种电池的说法正确的是( )A、放电时氧气发生氧化反应 B、放电时电子向负极移动 C、放电时电能转化为化学能 D、能量密度高可能是因为锂的相对原子质量小8. 镉镍可充电电池的充、放电反应如下:Cd + 2NiO(OH) + 2H2OCd(OH)2 + 2Ni(OH)2。则该电池充电时阳极放电的是( )A、Cd(OH)2 B、Cd C、Ni(OH)2 D、NiO(OH)9. 下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )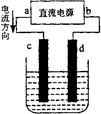 A、a为负极,b为正极 B、a为阳极,b为阴极 C、电解过程中,d电极质量增加 D、电解过程中,氯离子浓度不变10. 如图所示是电解 溶液的装置,其中 、 为石墨电极。则下列有关判断正确的是( )
A、a为负极,b为正极 B、a为阳极,b为阴极 C、电解过程中,d电极质量增加 D、电解过程中,氯离子浓度不变10. 如图所示是电解 溶液的装置,其中 、 为石墨电极。则下列有关判断正确的是( ) A、 为负极、 为正极 B、 电极发生了还原反应 C、电解过程中, 电极质量增如 D、溶液中电子移动方向为11. 下列有关电化学原理的说法正确的是( )A、铝—空气燃料电池以KOH为电解液时,负极反应为: B、用电解法精炼铜,阳极反应为: C、钢铁在中性条件下被腐蚀,正极反应为: D、电解法冶炼铝时,阳极反应为:12. 判断如图原电池装置图示中电子或离子流向、正极或负极等标注正确的是( )
A、 为负极、 为正极 B、 电极发生了还原反应 C、电解过程中, 电极质量增如 D、溶液中电子移动方向为11. 下列有关电化学原理的说法正确的是( )A、铝—空气燃料电池以KOH为电解液时,负极反应为: B、用电解法精炼铜,阳极反应为: C、钢铁在中性条件下被腐蚀,正极反应为: D、电解法冶炼铝时,阳极反应为:12. 判断如图原电池装置图示中电子或离子流向、正极或负极等标注正确的是( ) A、图甲铅蓄电池 B、图乙锌银纽扣电池 C、图丙燃料电池 D、图丁锌铜原电池13. 我国《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种新型“全氢电池”,能量效率可达。下列说法错误的是 ( )
A、图甲铅蓄电池 B、图乙锌银纽扣电池 C、图丙燃料电池 D、图丁锌铜原电池13. 我国《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种新型“全氢电池”,能量效率可达。下列说法错误的是 ( ) A、该装置将化学能转化为电能 B、离子交换膜不允许和通过 C、吸附层为负极,电极反应式为 D、电池总反应为14. 氨—空气燃料电池的结构如图所示。关于该电池的工作原理,下列说法正确的是( )
A、该装置将化学能转化为电能 B、离子交换膜不允许和通过 C、吸附层为负极,电极反应式为 D、电池总反应为14. 氨—空气燃料电池的结构如图所示。关于该电池的工作原理,下列说法正确的是( ) A、b极发生氧化反应 B、O2-由b极移向a极 C、a极的电极反应:2NH3+3O2-+6e-=N2+3H2O D、理论上消耗2molNH3 , 同时消耗33.6LO215. 银锌纽扣电池的电池反应式为:。下列说法正确的是( )
A、b极发生氧化反应 B、O2-由b极移向a极 C、a极的电极反应:2NH3+3O2-+6e-=N2+3H2O D、理论上消耗2molNH3 , 同时消耗33.6LO215. 银锌纽扣电池的电池反应式为:。下列说法正确的是( ) A、锌是阴极,发生还原反应 B、电解液可以用硫酸代替 C、电池工作时,移向极 D、工作时转移电子 , 则消耗的质量为6.5g16. 海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是( )
A、锌是阴极,发生还原反应 B、电解液可以用硫酸代替 C、电池工作时,移向极 D、工作时转移电子 , 则消耗的质量为6.5g16. 海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是( ) A、海水起电解质溶液作用 B、N极仅发生的电极反应: C、玻璃陶瓷具有传导离子和防水的功能 D、该锂-海水电池属于一次电池17. 太阳能光伏电池电解水制高纯氢的工作示意图如下。下列相关叙述错误的是( )
A、海水起电解质溶液作用 B、N极仅发生的电极反应: C、玻璃陶瓷具有传导离子和防水的功能 D、该锂-海水电池属于一次电池17. 太阳能光伏电池电解水制高纯氢的工作示意图如下。下列相关叙述错误的是( ) A、连接时电极1附近pH降低 B、连接时,溶液中的阴离子向电极2迁移 C、连接时电极3上NiO(OH)被还原为 D、交替连接、时,电极3附近的也会交替消耗和生成18. 电池比能量高,在汽车、航天等领域具有良好的应用前景.近年来科学家研究了一种光照充电电池(如图所示).光照时,光催化电极产生电子和空穴 , 驱动阴极反应和阳极反应对电池进行充电.下列叙述错误的是( )
A、连接时电极1附近pH降低 B、连接时,溶液中的阴离子向电极2迁移 C、连接时电极3上NiO(OH)被还原为 D、交替连接、时,电极3附近的也会交替消耗和生成18. 电池比能量高,在汽车、航天等领域具有良好的应用前景.近年来科学家研究了一种光照充电电池(如图所示).光照时,光催化电极产生电子和空穴 , 驱动阴极反应和阳极反应对电池进行充电.下列叙述错误的是( ) A、充电时,电池的总反应 B、充电效率与光照产生的电子和空穴量有关 C、放电时,从正极穿过离子交换膜向负极迁移 D、放电时,正极发生反应19. 科学家设计了一种高效、低能耗制备H2O2的装置,装置如图所示。下列有关说法错误的是( )
A、充电时,电池的总反应 B、充电效率与光照产生的电子和空穴量有关 C、放电时,从正极穿过离子交换膜向负极迁移 D、放电时,正极发生反应19. 科学家设计了一种高效、低能耗制备H2O2的装置,装置如图所示。下列有关说法错误的是( ) A、阴极区产生2molOH-时,参加反应的O2在标准状况下的体积为11.2L B、a为电源的正极 C、阳极区反应为
A、阴极区产生2molOH-时,参加反应的O2在标准状况下的体积为11.2L B、a为电源的正极 C、阳极区反应为 −2e-+3OH-=2H2O+
−2e-+3OH-=2H2O+ D、该装置中,离子交换膜为阴离子交换膜
20. 利用微生物除去废水中的乙酸钠和氯苯(
D、该装置中,离子交换膜为阴离子交换膜
20. 利用微生物除去废水中的乙酸钠和氯苯( ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( ) A、A极上的电极反应式为
A、A极上的电极反应式为 +e-=Cl-+
+e-=Cl-+ B、每除去1mol氯苯,同时产生11.2L(标准状况)
C、电子流向:B极→导线→A极→溶液→B极
D、该装置在高温环境中工作效率更高
B、每除去1mol氯苯,同时产生11.2L(标准状况)
C、电子流向:B极→导线→A极→溶液→B极
D、该装置在高温环境中工作效率更高
二、综合题
-
21. 请仔细观察下列四种装置的构造示意图,完成下列问题。

图1 锌锰电池

图2 碱性锌锰电池

图3 铅—硫酸蓄电池

图4 锌银纽扣电池
(1)、碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2 , 则负极的电极反应式: 。(2)、碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是。(3)、铅—硫酸蓄电池放电过程中,H2SO4浓度(填“变大”“变小”或“不变”),充电时阴极的电极反应式为。(4)、锌银纽扣电池在工作过程中(填物质名称)被还原。22.银锌电池广泛用于各种电子仪器的电源,它的充放电过程可表示为:2Ag+Zn(OH)2
 Ag2O+Zn+H2O回答下列有关问题.(1)、电池的放电过程是(填“①”或“②”).(2)、该电池属于性电池(填“酸”、“碱”或“中”).(3)、写出充电时阳极的电极反应式:(4)、充电时,电池的正极应接电源的极.23. 下图是实现对天然气中和高效去除的协同转化装置,电极材料是石墨烯(石墨烯包裹的)和石墨烯。
Ag2O+Zn+H2O回答下列有关问题.(1)、电池的放电过程是(填“①”或“②”).(2)、该电池属于性电池(填“酸”、“碱”或“中”).(3)、写出充电时阳极的电极反应式:(4)、充电时,电池的正极应接电源的极.23. 下图是实现对天然气中和高效去除的协同转化装置,电极材料是石墨烯(石墨烯包裹的)和石墨烯。 (1)、该装置是装置(填“电解池”或“原电池”),上述装置中光伏电池是。把太阳能转化成(填“直流电”或“交流电”)。硅基光伏电池工作时,硅原子处于(填“基态”或“激发态”),光伏电池提供的能源是次能源。(2)、石墨烯做极,电极反应式为(3)、石墨烯的电势比石墨烯的电势(填“高”或“低”)。(4)、协同转化的总反应方程式为 , 除硫反应的离子方程式为24. 当今,世界多国相继规划了碳达峰、碳中和的时间节点,因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。问答下列问题:(1)、I.CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
(1)、该装置是装置(填“电解池”或“原电池”),上述装置中光伏电池是。把太阳能转化成(填“直流电”或“交流电”)。硅基光伏电池工作时,硅原子处于(填“基态”或“激发态”),光伏电池提供的能源是次能源。(2)、石墨烯做极,电极反应式为(3)、石墨烯的电势比石墨烯的电势(填“高”或“低”)。(4)、协同转化的总反应方程式为 , 除硫反应的离子方程式为24. 当今,世界多国相继规划了碳达峰、碳中和的时间节点,因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。问答下列问题:(1)、I.CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:主反应:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H1=-156.9 kJ·mol-1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
已知2H2(g)+O2(g)2H2O(g) △H3= -395.6 kJ·mol-1。
CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=。
(2)、加氢合成甲烷时,通常控制温度为500℃左右,理由是。(3)、II.二氧化碳合成甲醇的反应为: CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49 kJ·mol-1573 K时,在体积为2 L的刚性容器中,投入2 mol CO2和6 mol H2 , 合成总反应达到平衡时,CO2的平衡转化率为60%。

①该反应的平衡常数K=L2/mol2 (保留1位小数)。
②为了提高CO2的平衡转化率可以采取的措施有 ( 填写两项措施)。
③图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线 (填 “m”或“n”)。
④测得在相同时间内,不同温度下H2的转化率如图2所示,v(a)逆v(c)逆(填“>”“<”或“=”)。
(4)、用如图装置模拟科学研究在碱性环境中电催化还原CO2制乙烯(X、Y均为新型电极材料,可减少CO2和碱发生副反应),装置中X电极为 (填“正”“负”“阴”或“阳”)极,Y极上的电极反应式为。 25. “绿水青山就是金山银山”,研究消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。(1)、已知:
25. “绿水青山就是金山银山”,研究消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。(1)、已知:写出C与反应生成的热化学方程式。
(2)、已知:4CO(g)+2NO2(g)⇌4CO2(g)+N2(g)∆H=-1200kJ/mol。在恒容密闭容器中,投入和 , 经过一段时间后达到平衡状态,测得的转化率为。该温度下,反应的平衡常数为。(3)、原煤经热解、冷却得到的煤焦可用于的脱除。热解温度为得到的煤焦分别用表示,相关信息如下表:煤焦
元素分析/%
比表面积
C
H
80.79
2.76
105.69
84.26
0.82
8.98
将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。
[已知:的脱除主要包含吸附和化学还原()两个过程]

①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,单位时间内对NO的脱除率比的高,可能原因是。(答两条)。
②后,随着温度升高,单位时间内NO的脱除率增大的原因是。
(4)、电解氧化吸收法:其原理如图3所示:
①从A口中出来的物质的是。
②写出电解池阴极的电极反应式。