人教【新课标】高中化学一轮复习:专题10化学反应速率与化学平衡
试卷更新日期:2022-06-24 类型:一轮复习
一、单选题
-
1. 反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )A、v(D)=0.45mol·L-1·min-1 B、v(B)=0.01mol·L-1·s-1 C、v(C)=0.40mol·L-1·min-1 D、v(A)=0.15mol·L-1·min-12. 下列体系加压后,对化学反应速率没有影响的是( )A、2SO2+O2 2SO3 B、CO+H2O(g) CO2+H2 C、CO2+H2O H2CO3 D、OH-+H+=H2O3. 某温度时,反应SO2(g)+1/2O2(g) SO3(g)的平衡常数K=50。在同一温度下,反应2SO3(g) 2SO2 (g)+O2(g)的平衡常数K1应为( )A、2 500 B、100 C、4×10-4 D、2×10-24. 一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的( )A、CaCO3(s) B、Na2SO4溶液 C、KNO3溶液 D、CuSO4(s)5. 在一定温度下,将气体X和Y各3 mol充入10 L恒容密闭容器中,发生反应:3X(g)+Y(g) 2Z(g)+ W(g)。经过8min,反应达到平衡状态,此时Z的物质的量为1.6 mol。下列关于反应开始至第8 min时的平均反应速率的计算正确的是( )A、v(X)=0.30 mol/(L·min) B、v(Y)=0.02 mol/(L·min) C、v(Z)=0.02 mol/(L·min) D、v(W)=0.10 mol/(L·min)6. 下列措施对增大反应速率明显有效的是( )A、Al在氧气中燃烧生成Al2O3 , 将Al片改成Al粉 B、Fe与稀硫酸反应制取H2时,改用浓硫酸 C、在K2SO4与BaCl2两溶液反应时,增大压强 D、Na与水反应时增大水的用量7. 在容积不变的密闭容器中发生反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,830℃时反应的平衡常数是1.0,下列说法正确的是( )A、容器内的压强不变时,说明反应达到平衡状态 B、若平衡时移走CO2 , 则平衡向正反应方向移动,化学反应速率加快 C、830℃时,充入0.1molCO和0.3molH2O保持温度不变,CO平衡转化率为75% D、1000℃时,某时刻CO2、H2、CO和H2O的浓度均为0.05mol/L,此时平衡向正反应方向移动8. 碳是生命的核心元素,碳及其化合物在工农业生产中有着广泛的应用。工业上用CO2生产CH3OH燃料,其热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。燃煤燃烧时生成的CO2用氨的饱和NaCl溶液吸收,可得到NaHCO3等化工产品。CO2会引起温室效应,我国力争在2060年前实现“碳中和”。“碳中和”是指企业、团体或个人测算在一定时间内直接或间接产生的温室气体排放总量,然后通过植物造树造林、节能减排等形式,抵消自身产生的排放量,CO2实现“零排放”。对于反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),下列有关说法正确的是( )A、增大的值,可提高H2的转化率 B、升高温度能提高CO2的反应速率和转化率 C、达平衡时缩小容器体积,(正)增大,(逆)减小 D、1molCO2和3molH2充分反应时放出的热量为49.0kJ9. 已知: , 向一恒温恒容的密闭容器中充入1 mol A和3 mol B发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是( )
 A、t2时改变的条件:向容器中加入C B、平衡常数K:K(II)<K(I) C、平衡时A的体积分数:(II)<(I) D、容器内压强不变,表明反应达到平衡10. 在某一恒温容积可变的密闭容器中发生反应:A(g)+B(g)2C(g)。反应速率随时间的变化如图所示。下列说法正确的是( )
A、t2时改变的条件:向容器中加入C B、平衡常数K:K(II)<K(I) C、平衡时A的体积分数:(II)<(I) D、容器内压强不变,表明反应达到平衡10. 在某一恒温容积可变的密闭容器中发生反应:A(g)+B(g)2C(g)。反应速率随时间的变化如图所示。下列说法正确的是( ) A、0~t2时,v正>v逆 B、t2时刻改变的条件是向密闭容器中加入C C、Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ D、Ⅰ、Ⅱ两过程达到平衡时,平衡常数KⅠⅡ11. 在一定条件下的1L密闭容器中,X、Y、C三种气体的物质的量随时间的变化如图所示。下列说法错误的是( )
A、0~t2时,v正>v逆 B、t2时刻改变的条件是向密闭容器中加入C C、Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ D、Ⅰ、Ⅱ两过程达到平衡时,平衡常数KⅠⅡ11. 在一定条件下的1L密闭容器中,X、Y、C三种气体的物质的量随时间的变化如图所示。下列说法错误的是( ) A、0~15min,消耗C的平均速率约为0.033mol•L-1•min-1 B、X、Y、C三种气体发生反应的化学方程式为:Y(g)+3X(g)2C(g) C、反应开始到25min,X的转化率为25% D、25min时改变的一个条件可能是缩小容器体积12. 在金催化剂表面上进行某反应历程如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是( )
A、0~15min,消耗C的平均速率约为0.033mol•L-1•min-1 B、X、Y、C三种气体发生反应的化学方程式为:Y(g)+3X(g)2C(g) C、反应开始到25min,X的转化率为25% D、25min时改变的一个条件可能是缩小容器体积12. 在金催化剂表面上进行某反应历程如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是( ) A、该反应的热效应 >0 B、反应过程中发生非极性键的断裂与生成 C、其他条件不变,使用另一高效催化剂可使CO的平衡转化率增大 D、该历程中最大能垒(活化能)步骤的反应式为13. CO甲烷化反应为: 。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢 。
A、该反应的热效应 >0 B、反应过程中发生非极性键的断裂与生成 C、其他条件不变,使用另一高效催化剂可使CO的平衡转化率增大 D、该历程中最大能垒(活化能)步骤的反应式为13. CO甲烷化反应为: 。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢 。
CO(g)+H2(g) CO(g)+·H ·CHO ·CH+H2O(l)→CH4(g)
下列说法错误的是( )
A、步骤①只有非极性键断裂 B、步骤②速率最慢的原因可能是其活化能最高 C、步骤③需要吸收热量 D、使用该催化剂不能有效提高CO平衡转化率14. 中科院化学研究所最新报道了化合物1催化CO2的氢化机理。其中化合物1(催化剂,固态)→化合物2(中间产物,固态)的过程和其相对能量曲线如图所示。下列有关该过程的说法正确的是( )
 A、过程中共经历三个过渡态TS11-2、I1-2、TS21-2 B、该过程的总反应速率主要由过程②决定 C、升高温度,有利于提高I1-2的平衡转化率 D、过程①的热化学方程式为I(s)+CO2(g)=I1-2(s) ∆H=-2.08 kJ·mol-115. 在刚性密闭容器中充入CO2和H2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H,测得反应过程如图所示。下列说法正确的是( )
A、过程中共经历三个过渡态TS11-2、I1-2、TS21-2 B、该过程的总反应速率主要由过程②决定 C、升高温度,有利于提高I1-2的平衡转化率 D、过程①的热化学方程式为I(s)+CO2(g)=I1-2(s) ∆H=-2.08 kJ·mol-115. 在刚性密闭容器中充入CO2和H2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H,测得反应过程如图所示。下列说法正确的是( ) A、平衡常数:K1>K2 B、反应温度:T2>T1 C、加催化剂,△H不变 D、平衡后再通入CO2 , 其转化率增大16. 在体积均为1.0L的恒容密闭容器甲、乙中,起始投料量如表,在不同温度下发生反应:CO2(g)+C(s)2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是( )
A、平衡常数:K1>K2 B、反应温度:T2>T1 C、加催化剂,△H不变 D、平衡后再通入CO2 , 其转化率增大16. 在体积均为1.0L的恒容密闭容器甲、乙中,起始投料量如表,在不同温度下发生反应:CO2(g)+C(s)2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是( )容器
n(CO2)/mol
n(C)/mol
n(CO)/mol
甲
0.1
0.3
0
乙
0
0
0.4
 A、曲线Ⅰ对应的是甲容器 B、a、b两点所处状态的压强大小关系:9pa>14pb C、c点:CO的体积分数> D、900K时,若起始向容器乙中加入CO、CO2、C各1mol,则v(正)>v(逆)17. 甲醛中木材加工、医药等方面有重要用途。甲醇利用脱氢法可制备甲醛,主要反应为:CH3OH(g) HCHO(g)+H2(g) 。Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
A、曲线Ⅰ对应的是甲容器 B、a、b两点所处状态的压强大小关系:9pa>14pb C、c点:CO的体积分数> D、900K时,若起始向容器乙中加入CO、CO2、C各1mol,则v(正)>v(逆)17. 甲醛中木材加工、医药等方面有重要用途。甲醇利用脱氢法可制备甲醛,主要反应为:CH3OH(g) HCHO(g)+H2(g) 。Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下: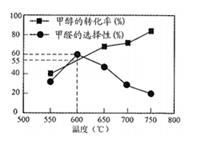
历程ⅰ:
历程ⅱ:
历程ⅲ:
历程ⅳ:
如图所示为在体积2L的恒容容器中,投入1molCH3OH,在碳酸钠催化剂作用下,经过
5min反应,测得甲醇转化率与甲醛的选择性与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比),下列有关说法正确的是( )
A、600℃时,前5min内生成甲醛的平均速率v(HCHO)=0.055 B、700℃时,反应历程ⅱ的速率小于反应历程ⅲ的速率 C、脱氢法制甲醛中,在高温高压条件下更有利于提高平衡产率 D、反应历程ⅰ的活化能大于CH3OH(g) HCHO(g)+H2(g)的活化能18. 已知反应原理 ,在密闭容器中1mol 和足量C发生反应,相同时间内测得 的生成速率与 的生成速率随温度变化的关系如图1;维持温度不变,反应相同时间内测得 的转化率随压强的变化如图2。
下列说法错误的是( )
A、图1中的A,B,C三个点中只有C点是平衡点 B、图2中平衡常数K(F)=K(G) C、图2中E点的 小于F点的 D、图2中 的浓度19. 在一定温度下,将1molCO2和3molH2充入体积为1L的恒容密闭容器中发生反应并达到平衡:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0,测得平衡混合气体中CH3OH的物质的量分数为25%。下列说法不正确的是( )A、平衡混合气体中C原子的物质的量是1mol B、该反应的反应物的总能量高于生成物的总能量 C、该反应的化学平衡常数K= D、其他条件相同时,若起始充入2molCO2和6molH2 , 达到平衡时CH3OH的物质的量分数大于25%20. T1℃时,向1L密闭容器中充入10molH2和3molSO2发生反应:3H2(g)+SO2(g)H2S(g)+2H2O(g) △H<0。部分物质的物质的量n(X)随时间t变化如图中实线所示。下列说法正确的是( ) A、实线a代表n(H2O)随时间变化的曲线 B、t1min时,v正(SO2)<v逆(H2S) C、该反应的平衡常数K=L•mol-1 D、若该反应在T2℃(T2<T1)时进行,则虚线b可表示n(SO2)的变化21. 利用工业废气中的CO2制备甲醇。该过程发生的主要反应如下:
A、实线a代表n(H2O)随时间变化的曲线 B、t1min时,v正(SO2)<v逆(H2S) C、该反应的平衡常数K=L•mol-1 D、若该反应在T2℃(T2<T1)时进行,则虚线b可表示n(SO2)的变化21. 利用工业废气中的CO2制备甲醇。该过程发生的主要反应如下:反应I: CO2(g)+ 3H2(g)= CH3OH(g)+ H2O(g) △H1= - 49.4 kJ·mol-1
反应II: CO2(g)+ H2(g)= CO(g)+H2O(g)△H2=+41.1 kJ·mol-1
反应III: CO(g)+ 2H2(g)= CH3OH(g) △H3= -90.5 kJ·mol-1
恒压条件下,将n(CO2):n(H2)为1 :3的混合气体以-定流速通过装有催化剂的反应管,在出口处测得CO2转化率、CH3OH产率[× 100%与温度的关系如图所示。

下列说法正确的是( )
A、反应I的平衡常数可表示为K= B、反应3CO(g)+ 2H2O(g)= 2CO2(g)+ CH3OH(g)的△H= +172.7 kJ·mol-1 C、240℃时,CH3OH产率最大,说明反应I、反应III已达到平衡状态 D、提高CO2转化为CH3OH的转化率,可以研发在低温区高效的催化剂二、综合题
-
22.(1)、(Ι)300 ℃时,将2mol A和2mol B两种气体混合于2 L密闭容器中,
发生如下反应:3A(g)+B(g) 2 C(g)+2D(g) ΔH,2min末达到平衡,生成0.8mol D。
300℃时,该反应的平衡常数表达式为K= , 已知K300℃<K350℃ , 则ΔH0(填“>”或“<”)。
(2)、在2min末时,B的平衡浓度为。(3)、若温度不变,缩小容器容积,则A的转化率(填“增大”、“减小”或“不变”)。(4)、(Ⅱ)硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g) 2SO3(g)。一定条件下,SO2与O2反应10min后,若SO2和SO3物质的量浓度分别为1mol/L和3mol/L,则10min生成SO3的化学反应速率为。
(5)、下列关于该反应的说法正确的是______。A、增加O2的浓度能加快反应速率 B、降低体系温度能加快反应速率 C、使用催化剂能加快反应速率 D、一定条件下达到反应限度时SO2全部转化为SO3(6)、工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式:。23. 工业合成氨技术反应原理为:N2 (g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1(1)、T ℃ 时,反应达到平衡,测得 υ(NH3)=0.12 mol·L-1·min -1① υ(N2)=mol·L-1·min -1
② 化学平衡常数表达式 K=
(2)、在其他条件相同时,图为分别测定不同压强、不同温度下,N2 的平衡转化率。
L 表示 , 其中 X1 X2(填“>”或“<)
24. 随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点.完成下列填空:
(1)、目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
v正
v逆
平衡常数K
转化率α
(2)、相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:[CO2]/mol•L﹣1
[H2]/mol•L﹣1
[CH4]/mol•L﹣1
[H2O]/mol•L﹣1
平衡Ⅰ
a
b
c
d
平衡Ⅱ
m
n
x
y
a、b、c、d与m、n、x、y之间的关系式为 .
(3)、碳酸:H2CO3 , Ki1=4.3×10﹣7 , Ki2=5.6×10﹣11草酸:H2C2O4 , Ki1=5.9×10﹣2 , Ki2=6.4×10﹣5
0.1mol/LNa2CO3溶液的pH0.1mol/LNa2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是 . 若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是 . (选填编号)
a.[H+]>[HC2O4﹣]>[HCO3﹣]>[CO32﹣] b.[HCO3﹣]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]
c.[H+]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣] d.[H2CO3]>[HCO3﹣]>[HC2O4﹣]>[CO32﹣]
(4)、人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3﹣⇌H2CO3 , 当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象.25. 回答下列问题:(1)、I.如表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用10mLH2O2制取150mLO2所需的时间(秒)。30%H2O2
15%H2O2
10%H2O2
5%H2O2
无催化剂、不加热
几乎不反应
几乎不反应
几乎不反应
几乎不反应
无催化剂、加热
360s
480s
540s
720s
MnO2催化剂、加热
10s
25s
60s
120s
该研究小组在设计方案时。考虑了浓度、、等因素对过氧化氢分解速率的影响。
(2)、II.100mL1mol·L-1稀硫酸与过量锌粒反应,一定温度下,为了减缓反应速率,又不影响生成氢气的总量,可采取的措施是____。A、加入少量碳酸钠粉末 B、加入少量硫酸铜溶液 C、加入适量Na2SO4溶液 D、加热 E、加水(3)、III.一定温度下某反应在体积为5L的恒容密闭的容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
该反应的化学方程式为。
(4)、反应开始至2分钟时,B的平均反应速率为。(5)、由图求得平衡时A的转化率为。(6)、平衡时体系内的压强与初始时压强之比为。