人教【新课标】高中化学一轮复习:专题8原子结构 元素周期表
试卷更新日期:2022-06-23 类型:一轮复习
一、单选题
-
1. 下列各图为元素周期表的一部分,表中数字为原子序数,其中X为17的是( )A、
 B、
B、 C、
C、 D、
D、 2. M2+离子有2个电子层,则M在周期表的位置是( )A、第二周期0族 B、第二周期VII族 C、第二周期IIA族 D、第三周期IIA族3. 下列有关氢化物的叙述正确的是( )A、稳定性: B、还原性: C、LiH中阴阳离子半径:阳离子>阴离子 D、HF的电子式:
2. M2+离子有2个电子层,则M在周期表的位置是( )A、第二周期0族 B、第二周期VII族 C、第二周期IIA族 D、第三周期IIA族3. 下列有关氢化物的叙述正确的是( )A、稳定性: B、还原性: C、LiH中阴阳离子半径:阳离子>阴离子 D、HF的电子式: 4. 下列有关性质的比较,错误的是( )A、金属性: B、碱性: C、酸性: D、沸点:5. 下列关于物质性质的比较,错误的是( )A、酸性强弱: B、原子半径大小: C、碱性强弱: D、金属性强弱:6. 短周期元素的四种离子、、、都具有相同的电子层结构,下列说法错误的是( )A、四种离子的质子数: B、四种元素的电负性:Z>W>Y>X C、四种离子的半径: D、四种元素原子的最外层电子数目:W>Z>X>Y7. 甲~戊均为短周期元素,在元素周期表中的相对位置如图2所示;戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是( )
4. 下列有关性质的比较,错误的是( )A、金属性: B、碱性: C、酸性: D、沸点:5. 下列关于物质性质的比较,错误的是( )A、酸性强弱: B、原子半径大小: C、碱性强弱: D、金属性强弱:6. 短周期元素的四种离子、、、都具有相同的电子层结构,下列说法错误的是( )A、四种离子的质子数: B、四种元素的电负性:Z>W>Y>X C、四种离子的半径: D、四种元素原子的最外层电子数目:W>Z>X>Y7. 甲~戊均为短周期元素,在元素周期表中的相对位置如图2所示;戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是( )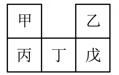 A、原子半径:丁>戊>乙 B、非金属性:戊>丁>丙 C、甲的氢化物遇氯化氢一定有白烟产生 D、丙的最高价氧化物对应的水化物一定能与强碱反应8. 短周期主族元素X、Y、Z、W的原子序数依次增大。元素X在常见化合物中均显负价,X、Y的最外层电子数之和与W的最外层电子数相等,Z的单质能与Y的最高价氧化物对应的水化物反应且有氢气生成。下列说法一定正确的是( )A、简单离子半径的大小顺序:W>Y>X B、Z的最高价氧化物对应的水化物是两性氢氧化物 C、X的最简单氢化物沸点高于W的最简单氢化物沸点 D、和均具有漂白性,但漂白原理不同9. 不同主族的短周期元素X、Y、Z、W其原子序数依次增大,X、Y的简单离子的电子层结构相同,短周期主族元素原子中Y的原子半径最大,Z原子最外层电子数是K层的3倍。下列说法错误的是( )A、熔化YW时离子键被破坏 B、X的简单氢化物可作制冷剂 C、离子的还原性:Z>W D、Y的氧化物为离子化合物,不含共价键10. X、Y、Z、W是四种原子序数依次增大的短周期元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子最外层电子数比Z原子的最外层电子数多1,下列说法正确的是( )
A、原子半径:丁>戊>乙 B、非金属性:戊>丁>丙 C、甲的氢化物遇氯化氢一定有白烟产生 D、丙的最高价氧化物对应的水化物一定能与强碱反应8. 短周期主族元素X、Y、Z、W的原子序数依次增大。元素X在常见化合物中均显负价,X、Y的最外层电子数之和与W的最外层电子数相等,Z的单质能与Y的最高价氧化物对应的水化物反应且有氢气生成。下列说法一定正确的是( )A、简单离子半径的大小顺序:W>Y>X B、Z的最高价氧化物对应的水化物是两性氢氧化物 C、X的最简单氢化物沸点高于W的最简单氢化物沸点 D、和均具有漂白性,但漂白原理不同9. 不同主族的短周期元素X、Y、Z、W其原子序数依次增大,X、Y的简单离子的电子层结构相同,短周期主族元素原子中Y的原子半径最大,Z原子最外层电子数是K层的3倍。下列说法错误的是( )A、熔化YW时离子键被破坏 B、X的简单氢化物可作制冷剂 C、离子的还原性:Z>W D、Y的氧化物为离子化合物,不含共价键10. X、Y、Z、W是四种原子序数依次增大的短周期元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子最外层电子数比Z原子的最外层电子数多1,下列说法正确的是( ) A、氢化物的稳定性:Y>Z B、W和Z的最高化合价之差为1 C、化合物XW在水中能电离出 , XW为离子化合物 D、Y、Z均可以与X形成10电子微粒和18电子微粒11. 最新合成的化合物甲是一种新型农药,其结构如图所示。已知X、Y、Z、W是位于同一周期的短周期元素,W最外层电子数是Y电子总数的一半,Z最高正化合价与最低负化合价代数和为2。下列叙述错误的是( )
A、氢化物的稳定性:Y>Z B、W和Z的最高化合价之差为1 C、化合物XW在水中能电离出 , XW为离子化合物 D、Y、Z均可以与X形成10电子微粒和18电子微粒11. 最新合成的化合物甲是一种新型农药,其结构如图所示。已知X、Y、Z、W是位于同一周期的短周期元素,W最外层电子数是Y电子总数的一半,Z最高正化合价与最低负化合价代数和为2。下列叙述错误的是( ) A、该化合物中各原子均达到8电子稳定结构 B、Z的最高价含氧酸为强酸 C、简单离子半径:Z>W>X D、最高价氧化物水化物的酸性:W>Z12. 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是( )
A、该化合物中各原子均达到8电子稳定结构 B、Z的最高价含氧酸为强酸 C、简单离子半径:Z>W>X D、最高价氧化物水化物的酸性:W>Z12. 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是( ) A、Y的氢化物的熔点一定低于 Z的氢化物的熔点 B、Z元素能形成多种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应水化物的稀溶液反应有黄色浑浊和无色气体产生13. 一种新型漂白剂由短周期元素W、X、Y、Z组成,其结构如图所示,其中W、Y、Z三种元素分别位于不同的短周期且不同主族,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子层结构相同。下列叙述错误的是( )
A、Y的氢化物的熔点一定低于 Z的氢化物的熔点 B、Z元素能形成多种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应水化物的稀溶液反应有黄色浑浊和无色气体产生13. 一种新型漂白剂由短周期元素W、X、Y、Z组成,其结构如图所示,其中W、Y、Z三种元素分别位于不同的短周期且不同主族,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子层结构相同。下列叙述错误的是( ) A、元素的非金属性X>Y B、该漂白剂的漂白原理与漂白粉相似 C、工业上通常采用电解W的氯化物的水溶液制备单质W D、该漂白剂中X、Y原子最外层均满足8电子稳定结构14. 短周期主族元素R、X、Y、Z、W的原子序数依次增大,由这五种元素组成的一种化合物M常用作食品的增味剂,M的结构式如图所示。下列说法正确的是( )
A、元素的非金属性X>Y B、该漂白剂的漂白原理与漂白粉相似 C、工业上通常采用电解W的氯化物的水溶液制备单质W D、该漂白剂中X、Y原子最外层均满足8电子稳定结构14. 短周期主族元素R、X、Y、Z、W的原子序数依次增大,由这五种元素组成的一种化合物M常用作食品的增味剂,M的结构式如图所示。下列说法正确的是( ) A、原子半径:X>Y B、由R、Y、Z三种元素形成的化合物均为共价化合物 C、熔点:W2Z<R2Z D、工业上采用电解熔融的W2Z制备W单质15.
A、原子半径:X>Y B、由R、Y、Z三种元素形成的化合物均为共价化合物 C、熔点:W2Z<R2Z D、工业上采用电解熔融的W2Z制备W单质15.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
 A、原子半径的大小顺序为:rX>rY>rZ>rW>rQ B、离子Y2-和Z 3+的核外电子数和电子层数都不相同 C、元素W与Q的最高价氧化物对应的水化物的酸性W的强 D、元素X与元素Z的最高正化合价之和的数值等于816. W、X、Y、Z、Q均为短周期主族元素,且原子序数依次增加,由它们组成的单质或化合物存在以下转化关系。已知B、C、D为非金属单质,且在常温常压下都是气体,D常用于自来水的杀菌、消毒;化合物G的焰色试验呈黄色;化合物H常温常压下为液体。下列说法不正确的是( )
A、原子半径的大小顺序为:rX>rY>rZ>rW>rQ B、离子Y2-和Z 3+的核外电子数和电子层数都不相同 C、元素W与Q的最高价氧化物对应的水化物的酸性W的强 D、元素X与元素Z的最高正化合价之和的数值等于816. W、X、Y、Z、Q均为短周期主族元素,且原子序数依次增加,由它们组成的单质或化合物存在以下转化关系。已知B、C、D为非金属单质,且在常温常压下都是气体,D常用于自来水的杀菌、消毒;化合物G的焰色试验呈黄色;化合物H常温常压下为液体。下列说法不正确的是( ) A、原子半径:Z>X>Y>W B、最高价氧化物的水化物的酸性:Q>X C、化合物WQY中各原子均满足8电子稳定结构 D、化合物ZYW中含有离子键和极性共价键
A、原子半径:Z>X>Y>W B、最高价氧化物的水化物的酸性:Q>X C、化合物WQY中各原子均满足8电子稳定结构 D、化合物ZYW中含有离子键和极性共价键二、综合题
-
17. 下表列出了①~⑤五种元素在周期表中的位置:
族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
3
④
⑤
⑥
按要求回答下列问题:
(1)、元素⑥的最高正化合价是。(2)、元素⑤在周期表中的位置是。(3)、元素②和元素③的非金属性强弱关系是②③(选填“>”或“<”);表中所列六种元素的单质,常温下为有色气体的是(填化学式)。(4)、①~⑥六种元素中原子半径最大的是(填元素符号)。②③两种元素的最简单氢化物中最稳定的是(填化学式)(5)、元素③与元素④能形成原子个数比为1:1的化合物 Y,Y 在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:。18. 下表列出了①~⑨九种元素在周期表中的位置。族
周期ⅠA 0 1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 ② ③ ④ ⑤ 3 ⑥ ⑦ ⑧ ⑨ 请按要求回答下列问题:
(1)、①~⑨九种元素中非金属性最强的是(填元素符号)。(2)、元素⑧的原子结构示意图是;由①、④、⑥三种元素组成的化合物,其电子式是。(3)、元素②、⑧的气态氢化物的稳定性较强的是(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是(填化学式)。(4)、③、④、⑧三种元素的原子半径由大到小的顺序是(填元素符号)。(5)、元素⑤、⑥组成的化合物的化学键类型是。(6)、元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是19. 如图列出了①~⑩十种元素在周期表中的位置:族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
3
⑤
⑥
⑦
⑧
⑨
4
⑩
请回答下列问题:
(1)、上述元素中,M层电子数最多的是(填元素名称),最高价氧化物对应的水化物酸性最强的是(填酸的化学式)。(2)、由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是(用离子符号表示)。(3)、由元素①和④形成的18电子的物质的电子式为;由元素⑥和⑨形成化合物乙,请用电子式表示物质乙的形成过程:。(4)、元素⑦的最高价氧化物对应的水化物与元素⑨的最简单氢化物的水溶液反应的离子方程式为。(5)、请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系:。(6)、下列可以比较⑤、⑥两元素金属性强弱的实验是___________(填字母)。A、比较这两种元素最高价氧化物对应的水化物的碱性 B、将⑤的单质投入到⑥的盐溶液中 C、将形状、大小相同的这两种元素的单质分别与等体积 的水反应 D、比较这两种元素的单质与酸反应时失电子的数目三、推断题
-
20. 部分短周期元素的性质或原子结构如表:
元素编号
元素的性质或原子结构
X
其单质常用于计算机芯片
Y
最外层电子数为电子层数的3倍
Z
短周期失电子能力最强的元素
W
L层比M多2个电子
T
第3周期元素的简单离子的半径最小
回答下列问题:
(1)、X在元素周期表的位置 , 画出W简单离子的结构示意图。(2)、Y与Z按1:1形成的化合物的电子式为。(3)、某同学设计了如图装置来探究碳、X、W元素的得电子能力。
①B中反应的化学方程式为 , 能否说明得电子能力:W>碳,(填“能”或“否”),理由为。
②C中足量酸性KMnO4溶液的作用是。
③D装置可证明得电子能力:碳>X,D中试剂为 , 实验现象为。