人教【新课标】高中化学一轮复习:专题5常见的金属元素
试卷更新日期:2022-06-23 类型:一轮复习
一、单选题
-
1. 下列金属中,通常用电解法冶炼的是( )A、Fe B、Mg C、Hg D、Ag2. 宝鸡是青铜器的故乡,青铜是我国较早使用的金属材料,下列与铜有关的说法正确的是( )A、青铜的主要成分为铜、锌合金,博物馆中贵重青铜器常放在银质托盘上 B、铜的氧化物有CuO和Cu2O,它们在稀硫酸中反应原理相同 C、《本草纲目》中载有一药物,名“铜青”,铜青是铜器上的绿色物质,则铜青就是青铜 D、《淮南万毕术》中记载“曾青得铁则化为铜”,是古代湿法炼铜的方法,胆矾可作为湿法炼铜的原料3. 下列有关物质的性质与用途不具有对应关系的是( )A、单质铝能导电,可用于制作导线 B、熔点很高,可用于冶炼金属铝 C、有弱碱性,可用于治疗胃酸过多 D、明矾能水解形成胶体,可用于净水4. 下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )A、加热氧化铝 B、加热氧化汞 C、电解熔融氯化钠 D、氢气还原氧化铁5. 下列反应原理不符合工业冶炼金属实际情况的是( )A、2HgO2Hg+O2↑ B、4Al+3MnO22Al2O3+3Mn C、2MgO2Mg+O2↑ D、4CO+Fe3O4 3Fe+4CO26. 钠及其化合物的转化关系如下,下列分析正确的是( )
 A、和发生反应①转移电子 B、反应⑤和反应⑥都可说明属于碱性氧化物 C、反应⑥中只体现氧化性 D、上述转化中发生的反应有分解反应、化合反应、置换反应7. 根据下列实验操作,判断现象及结论均正确的是( )
A、和发生反应①转移电子 B、反应⑤和反应⑥都可说明属于碱性氧化物 C、反应⑥中只体现氧化性 D、上述转化中发生的反应有分解反应、化合反应、置换反应7. 根据下列实验操作,判断现象及结论均正确的是( )选项
实验操作
现象
结论
A
向某溶液中先加入几滴KSCN溶液,再通入氯气
开始无明显现象,后溶液变红
溶液中一定含Fe2+ , 一定不含Fe3+
B
向BaCl2 溶液中通入SO2气体
有白色沉淀生成
该白色沉淀为BaSO3
C
常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH
前者pH比后者的大
非金属性: S>C
D
在火焰上灼烧搅拌过某无色溶液的铂丝
火焰出现黄色
该溶液一定是钠盐溶液
A、A B、B C、C D、D8. 下列说法正确的是( )A、钠的化合物都是白色固体 B、焰色试验火焰呈黄色的肯定是钠盐 C、将氧化钠在氧气中加热不可能转化为过氧化钠 D、等质量固体分别与足量等浓度的盐酸反应,前者消耗的盐酸多9. 将Na、Mg、Al各0.3mol分别放入100mL、1mol/L的HCl中,同温同压下产生的气体的体积比是( )A、3:1:1 B、6:3:2 C、1:2:3 D、1:1:110. 把Ba(OH)2溶液滴入明矾(KAl(SO4)2)溶液中,使SO 全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )A、Al3+ B、Al(OH)3 C、Al3+和Al(OH)3 D、AlO11. 将一定质量的镁铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中逐滴加入 NaOH 溶液,生成沉淀的物质的量与加入的 NaOH 溶液体积的变化关系如图所示。则下列说法错误的是( ) A、镁和铝的总质量为9 g B、生成的氢气在标准状况下的体积为11.2 L C、最初20 mL NaOH溶液用于中和过量的硫酸 D、氢氧化钠溶液的物质的量浓度为5 mol·L-112. 将一定质量的镁铝合金投入一定体积10 mol·L-1的盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的质量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列说法错误的是( )
A、镁和铝的总质量为9 g B、生成的氢气在标准状况下的体积为11.2 L C、最初20 mL NaOH溶液用于中和过量的硫酸 D、氢氧化钠溶液的物质的量浓度为5 mol·L-112. 将一定质量的镁铝合金投入一定体积10 mol·L-1的盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的质量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列说法错误的是( ) A、该镁铝合金中铝的质量为5.4 g B、所用NaOH物质的量浓度为4.5 mol·L-1 C、反应中沉淀的物质的量最多时为0.35 mol D、溶解合金所用盐酸的体积为100 mL13. 由工业废渣(主要含Fe、Si、Al等的氧化物)制取聚合硫酸铁铝净水剂的流程如下:
A、该镁铝合金中铝的质量为5.4 g B、所用NaOH物质的量浓度为4.5 mol·L-1 C、反应中沉淀的物质的量最多时为0.35 mol D、溶解合金所用盐酸的体积为100 mL13. 由工业废渣(主要含Fe、Si、Al等的氧化物)制取聚合硫酸铁铝净水剂的流程如下: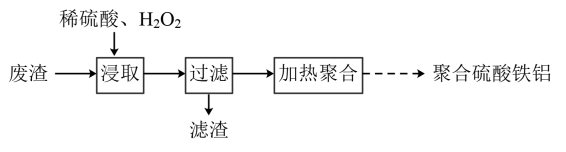
下列有关说法不正确的是( )
A、“浸取”时先将废渣粉碎并不断搅拌,有利于提高铁、铝元素浸取率 B、与稀硫酸反应的离子方程式为 C、“过滤”前用检验浸取液中是否存在的反应是氧化还原反应 D、聚合硫酸铁铝水解形成的胶体具有吸附作用14. 利用废铝箔(主要成分为 ,含少量 、 等)制明矾 的一种工艺流程如图:
下列说法错误的是( )
A、①中生成了 : B、操作 是过滤,以除去难溶于 溶液的杂质 C、②③中加入稀硫酸的作用均是除去杂质 D、由④可知,室温下明矾的溶解度小于 和 的溶解度15. 用黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe2O3)生产晶体Cu(NO3)2·3H2O的流程如图所示,下列说法正确的是( )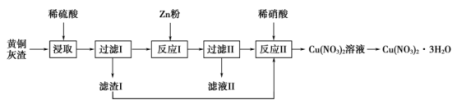 A、“浸取”时使用浓硫酸可加快反应速率 B、滤液II中一定含Zn2+、Fe2+、SO离子 C、若制得纯度较高的Cu(NO3)2·3H2O,反应中所加Zn需过量 D、将Cu(NO3)2溶液蒸发浓缩、冷却结晶、过滤得到Cu(NO3)2·3H2O16. 金属材料的发展极大地促进了人类社会的文明程度。如图是两种金属及其化合物的转化关系。下列说法错误的是( )
A、“浸取”时使用浓硫酸可加快反应速率 B、滤液II中一定含Zn2+、Fe2+、SO离子 C、若制得纯度较高的Cu(NO3)2·3H2O,反应中所加Zn需过量 D、将Cu(NO3)2溶液蒸发浓缩、冷却结晶、过滤得到Cu(NO3)2·3H2O16. 金属材料的发展极大地促进了人类社会的文明程度。如图是两种金属及其化合物的转化关系。下列说法错误的是( ) A、根据反应③可知氧化性:Fe3+>H2O2 B、向X溶液中滴入K3[Fe(CN)6]溶液,生成蓝色沉淀 C、反应③中稀硫酸仅表现酸性 D、反应①的离子方程式为Cu+H2O2+2H+=Cu2++2H2O
A、根据反应③可知氧化性:Fe3+>H2O2 B、向X溶液中滴入K3[Fe(CN)6]溶液,生成蓝色沉淀 C、反应③中稀硫酸仅表现酸性 D、反应①的离子方程式为Cu+H2O2+2H+=Cu2++2H2O二、综合题
-
17. 为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体( FeSO4·7H2O)并回收铜。
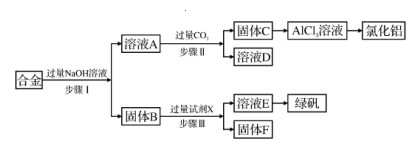
请回答下列问题:
(1)、步骤I的离子反应方程式为。(2)、试剂X是。(填名称)(3)、步骤I、II、III中均需进行的实验操作是。(4)、步骤II的化学方程式为。(5)、固体F是( 填化学式)。(6)、某研究性学习小组为测定溶液E (有少量已变质)的组成,进行了如下实验:①取少量待测溶液,加入适量淀粉KI溶液,溶液变为蓝色,该反应的离子方程式为 , 说明FeSO4溶液已变质。
②取50.0mL待测溶液,加入足量盐酸酸化的的BaCl2溶液,得23.3 g白色沉淀,则溶液中c(SO)=。
18. 榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如图: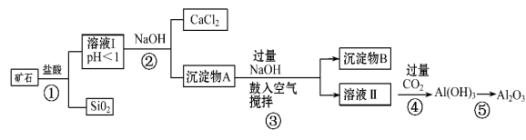 (1)、步骤①中加快反应速率的措施有(填一种)。(2)、溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有。(3)、鼓入空气并充分搅拌的目的是。(4)、工业上制取Al的反应方程式为。(5)、试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)。19. 我国某现代化铜冶炼厂排放的废水中含有较多的、、、和少量的 , 为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体()并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
(1)、步骤①中加快反应速率的措施有(填一种)。(2)、溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有。(3)、鼓入空气并充分搅拌的目的是。(4)、工业上制取Al的反应方程式为。(5)、试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)。19. 我国某现代化铜冶炼厂排放的废水中含有较多的、、、和少量的 , 为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体()并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
已知:加入的试剂①为溶液。
回答下列问题:
(1)、操作a的名称为;溶液A中所含的溶质主要为(填化学式)。(2)、加入的试剂③为(填试剂名称)。(3)、检验溶液D中的金属阳离子的具体操作及现象为 , 写出检验过程中属于氧化还原反应的离子方程式:。(4)、若取2mL溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为 , 此现象中涉及的氧化还原反应的化学方程式为。20. 明矾[KAl(SO4)2·12H2O]在造纸等方面应用广泛。工业上以废易拉罐(主要成分为Al和Fe)为原料制备明矾的工艺流程如图:
已知:不同温度KAl(SO4)2·12H2O的溶解度:
温度/℃
0
10
20
30
40
60
80
90
KAl(SO4)2·12H2O/g
3.00
3.99
5.90
8.39
11.7
24.8
71.0
109
回答下列问题:
(1)、“酸溶”中溶液中主要的金属离子有、Fe2+、Fe3+。(2)、“转化”中Fe2+转化为Fe3+ , 反应的离子方程式为。(3)、“调pH”约为3.7,滤渣②的主要成分是Fe(OH)3 , “调pH”的目的是。(4)、“沉铝”中加入NaHCO3目的是将Al3+转化为Al(OH)3 , 补全该反应的离子方程式。Al3++HCO=Al(OH)3↓+CO2↑
(5)、“操作”包括、、过滤、洗涤、干燥可得到明矾晶体。(6)、某工厂用m1kg废易拉罐(含Al5.4%)制备KAl(SO4)2·12H2O(相对分子质量为474),最终得到产品m2kg,产率为。三、推断题
-
21. 有一 无色溶液,除了水电离产生的离子外,可能还含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH、K+、CO、SO等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:
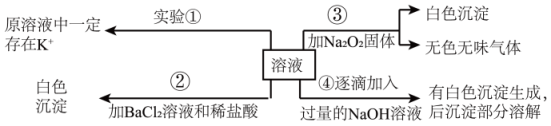
请你根据上述实验推断:
(1)、实验①的名称是。(2)、原溶液中除了水电离产生的离子外一定存在的阴离子有 , 一定不存在的阳离子有Fe3+、Cu2+、。(3)、实验②中发生反应的离子方程式为。(4)、实验③中产生无色无味气体所发生反应的化学方程式为。(5)、写出实验④中剩余沉淀的化学式:。(6)、写出实验④中,沉淀溶解过程中所发生反应的离子方程式:。