天津市南开区2022届高三下学期第三次模拟化学试题
试卷更新日期:2022-06-23 类型:高考模拟
一、单选题
-
1. 下列叙述错误的是( )A、食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用 B、大气污染物主要包括氮氧化物、硫氧化物、二氧化碳等 C、将垃圾进行分类处理,可实现资源的合理利用 D、硫酸铝可用于去除污水中的细小悬浮物2. 下列有关性质或数据比较正确的是( )A、键能:Cl-Cl>I-I B、第一电离能:B>Be C、离子半径:Mg2+> D、电负性:N>O3. 下列有关化学用语表示正确的是( )A、HClO的电子式:
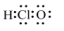 B、反-2-丁烯的键线式:
B、反-2-丁烯的键线式: C、CO2的空间结构模型:
C、CO2的空间结构模型: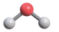 D、基态As原子的电子排布式:[Ar]3d104s24p3
4. 关于下列仪器使用的说法错误的是( )
D、基态As原子的电子排布式:[Ar]3d104s24p3
4. 关于下列仪器使用的说法错误的是( ) A、①、③可加热 B、③、⑤可用于物质分离 C、②、④可用作反应容器 D、②、④、⑤使用前需检漏5. 我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列有关黄芩素的说法错误的是( )
A、①、③可加热 B、③、⑤可用于物质分离 C、②、④可用作反应容器 D、②、④、⑤使用前需检漏5. 我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列有关黄芩素的说法错误的是( )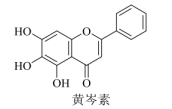 A、分子中有4种官能团 B、能与水形成分子间氢键 C、能与NaHCO3溶液反应 D、可发生取代、加成和氧化反应6. 设NA表示阿伏加德罗常数的数值。下列说法正确的是( )A、常温常压下,31gP4中所含P—P键数目为1.5NA B、标准状况下,11.2L甲烷和乙炔混合物中含氢原子数目为2NA C、1.000L0.1000的Na2CO3溶液中,阴离子数目为0.1000NA D、500℃下的密闭容器中,1molN2和3molH2催化反应后分子总数为2NA7. 最理想的“原子经济性反应”是指反应物的原子全部转化为期望的最终产物的反应。下列属于最理想的“原子经济性反应”的是( )A、用丙烯腈在酸性条件下水解制备丙烯酸的反应 B、用水杨酸与乙酸酐反应制备阿司匹林的反应 C、用乙醛发生羟醛缩合制备2-丁烯醛的反应 D、用环氧乙烷与水反应制备乙二醇的反应8. 下列反应的离子方程式错误的是( )A、向硫代硫酸钠溶液中加入稀硫酸: B、用铁氰化钾溶液检验亚铁离子: C、向氯化银悬浊液中加入硫化钠溶液: D、向硝酸银溶液中滴加氨水制银氨溶液:9. 在酸性溶液中,FeS2催化氧化的物质转化关系如图所示。
A、分子中有4种官能团 B、能与水形成分子间氢键 C、能与NaHCO3溶液反应 D、可发生取代、加成和氧化反应6. 设NA表示阿伏加德罗常数的数值。下列说法正确的是( )A、常温常压下,31gP4中所含P—P键数目为1.5NA B、标准状况下,11.2L甲烷和乙炔混合物中含氢原子数目为2NA C、1.000L0.1000的Na2CO3溶液中,阴离子数目为0.1000NA D、500℃下的密闭容器中,1molN2和3molH2催化反应后分子总数为2NA7. 最理想的“原子经济性反应”是指反应物的原子全部转化为期望的最终产物的反应。下列属于最理想的“原子经济性反应”的是( )A、用丙烯腈在酸性条件下水解制备丙烯酸的反应 B、用水杨酸与乙酸酐反应制备阿司匹林的反应 C、用乙醛发生羟醛缩合制备2-丁烯醛的反应 D、用环氧乙烷与水反应制备乙二醇的反应8. 下列反应的离子方程式错误的是( )A、向硫代硫酸钠溶液中加入稀硫酸: B、用铁氰化钾溶液检验亚铁离子: C、向氯化银悬浊液中加入硫化钠溶液: D、向硝酸银溶液中滴加氨水制银氨溶液:9. 在酸性溶液中,FeS2催化氧化的物质转化关系如图所示。
下列有关叙述正确的是( )
A、Fe2+是该反应的催化剂 B、反应中,FeS2作氧化剂 C、反应过程中须不断加入NO和O2 D、每消耗7molO2 , 溶液中最多增加4mol10. 下图是一种用于处理酸性废水中有机物及脱除硝态氮的微生物原电池的示意图。
下列有关该微生物电池的说法错误的是( )
A、电流由m极经外电路流向n极 B、H+可通过质子交换膜移向左侧极室 C、每消耗1molC6H12O6 , 外电路中转移24mol D、m电极反应式:11. Fe3+可与H2O、、等配体形成配位数为6的配离子,如[Fe(H2O)6]3+(浅紫色)、(红色)、(无色),但不能与形成配离子。某同学完成如下实验:
下列有关叙述错误的是( )
A、[Fe(H2O)6]3+为浅紫色,但溶液I却呈黄色,是Fe3+水解的产物所致 B、溶液II、III的颜色分别为红色和无色,说明其中不存在[Fe(H2O)6]3+ C、为了观察到溶液I中[Fe(H2O)6]3+的浅紫色,可向溶液中加入硝酸 D、已知Fe3+与、的反应在溶液中存在以下平衡: ; , 溶液II→溶液III,颜色由红色变为无色。若该反应是可逆反应,其平衡常数为12. 用下图所示装置进行气体x的性质实验,得出的实验结论正确的是( )
选项
实验操作
实验现象
实验结论
制备气体x
溶液a
A
电石与水反应
溴水
黄色褪去
C2H2与Br2发生加成反应
B
碳酸钠与醋酸溶液作用
Na2SiO3溶液
产生白色沉淀
H2CO3的酸性强于H2SiO3
C
乙醇与浓硫酸共热至170℃
KMnO4酸性溶液
紫色褪去
C2H4被氧化
D
溴乙烷与氢氧化钠醇溶液共热
Br2的四氯化碳溶液
橙红色褪去
C2H4与Br2发生加成反应
A、A B、B C、C D、D二、综合题
-
13. 铁、铜和镁是生命必需的元素,也是人类使用广泛的金属,铁和铜及其重要化合物在生产中有着重要的应用。回答下列问题:(1)、某元素X与铜同周期,基态X原子是该周期基态原子中未成对电子最多的,其原子结构示意图为。(2)、Fe2+变为基态铁原子时所得的电子填充到能级。(3)、新制备的Cu(OH)2可将乙醛氧化成乙酸(CH3COOH),而自身还原成Cu2O。1个乙酸分子中共平面的原子最多为个。图所示的Cu2O晶胞中,铜周围紧邻且等距的氧有个,已知其晶胞密度为bg/cm3 , 则该晶胞棱长为pm(设NA为阿伏加德罗常数的值)。
 (4)、叶绿素的结构示意如图所示。
(4)、叶绿素的结构示意如图所示。
①该结构中包含的作用力有(用字母填空)。
a.离子键 b.σ键 c.π键 d.分子间作用力
②其中碳原子的杂化类型为 , 碳、氮、氧三种元素的电负性由大到小的顺序是。元素As与N同族预测As的简单氢化物的VSEPR模型为 , 其键角109º28´(填“大于”、“小于”或“等于”)原因是。
14. (PAS)为治疗结核病药,其衍生物G的抗结核作用比PAS强20倍,且毒性比PAS低,对胃肠刺激作用也较小。现以水杨酸为原料合成G的途径如下(部分反应条件已省略)。
(PAS)为治疗结核病药,其衍生物G的抗结核作用比PAS强20倍,且毒性比PAS低,对胃肠刺激作用也较小。现以水杨酸为原料合成G的途径如下(部分反应条件已省略)。
回答下列问题:
(1)、写出PAS中官能团的名称:。(2)、B→C的反应类型为。(3)、F的结构简式。(4)、在催化剂和加热的条件下,C→D的化学方程式为。(5)、水杨酸在浓硫酸催化作用并加热的条件下,与乙酸酐反应可生成阿司匹林。在此过程中,部分水杨酸会发生聚合反应,聚合反应的化学方程式为。(6)、物质D有多种同分异构体,请写出符合下列条件的同分异构体的结构简式:。①属于芳香酯类化合物;②核磁共振氢谱有四组峰,且峰面积比为2﹕2﹕1﹕1。
(7)、设计由甲苯为起始原料,制备 的合成路线(无机试剂任选)(已知:—COOH为间位定位基)。 15. 化学是一门以实验为基础的学科,回答下列问题:(1)、在一支试管中加入1mLNa2S溶液,向其中边振荡边滴加H2SO3溶液,用浸NaOH溶液的棉团塞住试管口,可能观察到现象为 , 试管中发生反应化学方程式。
的合成路线(无机试剂任选)(已知:—COOH为间位定位基)。 15. 化学是一门以实验为基础的学科,回答下列问题:(1)、在一支试管中加入1mLNa2S溶液,向其中边振荡边滴加H2SO3溶液,用浸NaOH溶液的棉团塞住试管口,可能观察到现象为 , 试管中发生反应化学方程式。氧钒(IV)碱式碳酸铵晶体的化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O,难溶于水,是制备热敏材料VO2的原料。实验室以V2O5为原料合成该晶体的流程如图。

已知:+4价钒在弱酸性条件下具有还原性。
(2)、N2H4的电子式为 , 只用浓盐酸与V2O5反应也能制备VOCl2溶液,但从环保角度分析,该反应不被推广的主要原因是(用化学方程式表示)。(3)、步骤ii可在如图装置中进行。
①仪器b的名称是 , 盛装的试剂是。
②实验时,先关闭K2 , 打开K1 , 当观察到D中出现白色浑浊时,再关闭K1 , 打开K2 , 这样操作的目的是。
③反应结束后,得到紫红色晶体,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次。检验用饱和NH4HCO3溶液洗涤沉淀是否干净的操作是。
(4)、称量ag粗产品,用KMnO4溶液氧化,再除去多余的KMnO4(方法略),最后用0.1mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(滴定过程只发生反应),消耗标准溶液的体积为bmL。①粗产品中钒的质量分数为%(用含有a、b的式子表示)。
②若实验测得钒的质量分数偏大,则可能的原因是。
A.(NH4)Fe(SO4)标准溶液被氧化
B.滴定前平视读数,滴定终点时仰视读数
C.滴定前,滴定管内无气泡,滴定结束后尖嘴有气泡
16. 甲醇是基本有机原料之一,用于制造氯甲烷、甲胺和硫酸二甲酯等多种有机产品,甲醇可由CO与H2反应制得。回答下列问题:(1)、已知在25℃,101kPa下:甲醇(l)的燃烧热为727 , CO(g)的燃烧热为283 , H2O(g)=H2O(l) 。则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为。(2)、恒温恒压下,在容积可变的密闭容器中加入一定量的CO和H2发生反应制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示。
则T1T2(填“>”、“<”或“=”,下同),M点的正反应速率N点的逆反应速率。
(3)、密闭容器中,高温TK条件下,用CO还原氧化铁得到单质铁。若初始压强为pkPa,平衡后气体中CO的物质的量分数为a,此温度反应的平衡常数Kp=(Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数)。(4)、以甲醇为原料,通过电化学法可以合成碳酸二甲酯[(CH3O)2CO],工作原理如图所示。
①阳极的电极反应式为。
②若以铅蓄电池为电源,A应与铅蓄电池的(填“Pb”或“PbO2”)相连。