山东省潍坊市2022届高三下学期三模统考(5月)化学试题
试卷更新日期:2022-06-23 类型:高考模拟
一、单选题
-
1. 2022年北京冬奥会最大的特色之一是“绿色环保”。以下不符合“绿色环保”的是( )A、采用废弃塑料瓶制备环保布 B、采用聚乳酸制备可降解餐具 C、采用干冰制冷制备比赛用雪 D、采用露天焚烧处理生活垃圾2. 下列物质的应用涉及氧化还原反应的是( )A、利用氢氟酸刻蚀玻璃 B、利用活性炭由红糖制备白糖 C、煅烧石灰石制备生石灰 D、应用漂白粉对环境进行消杀3. 下列关于B、S、C及其化合物的结构与性质的论述错误的是( )A、C的电负性比B大,则C、B形成的二元化合物中,C显负化合价 B、和中B、S杂化轨道类型相同,二者均为正三角形结构 C、常温下为液体,说明是非极性分子 D、的硬度可与金刚石媲美,且熔点高,则为共价晶体4. 1934年,约里奥·居里夫妇用粒子(即氦核)轰击某金属原子得到 , 具有放射性,可衰变为 , 。基态Y原子3p能级半充满。下列说法错误的是( )A、X原子核内中子数与质子数之比为14∶13 B、X和Y的氧化物分别为碱性氧化物、酸性氧化物 C、第一电离能:X<Q<Y D、最高价氧化物对应水化物的酸性:Y>Q5. 维生素C也叫抗坏血酸(结构简式如下图甲),在人体内具有抗氧化、抗自由基的功效。脱氢抗坏血酸的结构简式如图乙。下列关于抗坏血酸和脱氢抗坏血酸的说法错误的是( )
 A、由抗坏血酸转化为脱氢抗坏血酸的反应是氧化反应 B、1mol抗坏血酸的酸性水解产物与足量Na反应产生3mol C、1mol脱氢抗坏血酸最多与3mol发生加成反应 D、脱氢抗坏血酸含苯环的同分异构体分子中有6个羟基6. 利用下图所示装置能达到相应目的的是( )
A、由抗坏血酸转化为脱氢抗坏血酸的反应是氧化反应 B、1mol抗坏血酸的酸性水解产物与足量Na反应产生3mol C、1mol脱氢抗坏血酸最多与3mol发生加成反应 D、脱氢抗坏血酸含苯环的同分异构体分子中有6个羟基6. 利用下图所示装置能达到相应目的的是( ) A、利用甲装置制取少量 B、利用乙装置测量化学反应速率 C、利用丙装置制备乙酸乙酯 D、利用丁装置对铁件进行保护7. 白炭黑(可用表示其组成)可广泛应用于日用化工、橡胶制品、电子工业等许多领域。以硅酸钠和二氧化碳为原料制备白炭黑的工艺流程如下:
A、利用甲装置制取少量 B、利用乙装置测量化学反应速率 C、利用丙装置制备乙酸乙酯 D、利用丁装置对铁件进行保护7. 白炭黑(可用表示其组成)可广泛应用于日用化工、橡胶制品、电子工业等许多领域。以硅酸钠和二氧化碳为原料制备白炭黑的工艺流程如下:
下列说法错误的是( )
A、硅酸钠水溶液必须用带玻璃塞的试剂瓶盛装 B、沉淀反应的离子方程式为 C、蒸发“滤液”所得晶体中含有离子键和极性共价键 D、用稀盐酸洗涤沉淀的目的是除去沉淀表面的8. 实验室利用液溴和乙烯反应制备1,2-二溴乙烷,装置如下图(夹持装置略)所示。下列说法错误的是( )
部分物质的物理性质如下表:
物质
密度/(g·cm-3)
熔点/℃
沸点/℃
乙醇
0.79
-130
78.5
1,2-二溴乙烷
2.2
9
132
A、利用装置甲制备乙烯时,温度控制在170℃左右 B、装置乙的玻璃管中有水柱急剧上升时,要减小乙醇消去反应的速率 C、装置丙中NaOH溶液的作用是除去乙烯中的 D、在生成的液体混合物中加入NaOH溶液,可除去其中的溴单质9. 工业上利用和生产尿素的原理可表示为:氨基甲基铵
下列对涉及的有关物质的说法错误的是( )
A、和尿素中的N的杂化方式相同 B、氨基甲酸铵的稳定性比尿素强 C、尿素中碳原子和氧原子的1个2p轨道重叠形成π键 D、1个尿素分子中最多有6个原子位于同一平面10. 我国科技工作者发明了一种可快速充、放电的铝离子电池,其放电时的工作原理示意图如下,正极反应。下列有关该电池的说法错误的是( )
图中的结构简式为
 A、Al为负极,电极反应为: B、离子液体中的[EMlm]Cl不参与反应,只起传递离子的作用 C、电池工作时,阳离子从负极区域移向正极区域 D、电路中转移1mol时,正极区域减少的质量为58g11. 靛蓝类色素是人类所知最古老的色素之一,广泛用于食品、医药和印染工业,靛蓝的结构简式如下图。下列关于靛蓝的说法错误的是( )
A、Al为负极,电极反应为: B、离子液体中的[EMlm]Cl不参与反应,只起传递离子的作用 C、电池工作时,阳离子从负极区域移向正极区域 D、电路中转移1mol时,正极区域减少的质量为58g11. 靛蓝类色素是人类所知最古老的色素之一,广泛用于食品、医药和印染工业,靛蓝的结构简式如下图。下列关于靛蓝的说法错误的是( ) A、分子式是 B、分子中的所有碳原子的杂化方式相同 C、分子中所有原子处于在同一平面 D、分子中有5种不同化学环境的氢原子12. 常温时,向10.00mL二元酸溶液中滴入一定浓度的NaOH溶液,混合液的pH随NaOH溶液体积变化的曲线如下图所示,P点恰好完全反应。若忽略溶液密度变化导致的体积变化,则下列说法正确的是( )
A、分子式是 B、分子中的所有碳原子的杂化方式相同 C、分子中所有原子处于在同一平面 D、分子中有5种不同化学环境的氢原子12. 常温时,向10.00mL二元酸溶液中滴入一定浓度的NaOH溶液,混合液的pH随NaOH溶液体积变化的曲线如下图所示,P点恰好完全反应。若忽略溶液密度变化导致的体积变化,则下列说法正确的是( ) A、NaOH溶液的浓度为 B、常温时,的第一步电离常数 C、酸式盐NaHX的水溶液显酸性 D、P点溶液中:
A、NaOH溶液的浓度为 B、常温时,的第一步电离常数 C、酸式盐NaHX的水溶液显酸性 D、P点溶液中:二、多选题
-
13. 下列实验操作不能达到目的的是( )
选项
实验目的
实验操作
A
除去乙醇中的少量乙酸
加入适量溶液,振荡、静置、分液
B
实验室制备少量胶体
在沸腾的蒸馏水中滴加几滴饱和溶液,继续煮沸至液体为红褐色为止
C
鉴别
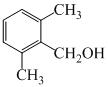 和
和
分别向盛有两种溶液的试管中滴加浓溴水
D
检验淀粉是否水解完全
取水解后的混合液,向其中加入新制的并加热
A、A B、B C、C D、D14. 采用乙醇-水-硫酸作电解质溶液,以对硝基苯甲酸( )为原料,通过电解的方法可制备对氨基苯甲酸(
)为原料,通过电解的方法可制备对氨基苯甲酸( ),电解装置如图所示(箭头表示电解池工作时离子的迁移方向)。下列有关说法错误的是( )
),电解装置如图所示(箭头表示电解池工作时离子的迁移方向)。下列有关说法错误的是( ) A、该装置中的阳离子交换膜为质子交换膜 B、乙醇-水-硫酸电解质溶液中的乙醇为溶剂 C、电极N为阳极,电极反应为
A、该装置中的阳离子交换膜为质子交换膜 B、乙醇-水-硫酸电解质溶液中的乙醇为溶剂 C、电极N为阳极,电极反应为 +6H+-6e-→
+6H+-6e-→ +2H2O
D、在反应过程中,储液罐甲中的pH始终保持不变
15. 2-甲基丙烯与HCl的加成反应有两种产物,这两种加成反应过程与其相应的能量变化曲线关系如下图所示。在恒容绝热密闭容器中通入一定量的2-甲基丙烯与HCl的混合物进行有关反应。下列说法正确的是( )
+2H2O
D、在反应过程中,储液罐甲中的pH始终保持不变
15. 2-甲基丙烯与HCl的加成反应有两种产物,这两种加成反应过程与其相应的能量变化曲线关系如下图所示。在恒容绝热密闭容器中通入一定量的2-甲基丙烯与HCl的混合物进行有关反应。下列说法正确的是( ) A、产物稳定性的强弱:产物1<产物2 B、反应的活化能大小:反应Ⅰ>反应Ⅱ C、升高温度,反应Ⅰ的逆反应速率变化值小于反应Ⅱ的逆反应速率变化值 D、2-甲基丙烯与的加成反应产物中,
A、产物稳定性的强弱:产物1<产物2 B、反应的活化能大小:反应Ⅰ>反应Ⅱ C、升高温度,反应Ⅰ的逆反应速率变化值小于反应Ⅱ的逆反应速率变化值 D、2-甲基丙烯与的加成反应产物中, 更稳定
更稳定
三、综合题
-
16. Be、Mg、Ca均为ⅡA族元素,这些元素及其化合物在人类生产、生活和科学研究中具有广泛的用途。回答下列问题:(1)、金属单质的熔点:MgCa(填“>”或“<”),原因是;最高价氧化物对应水化物的碱性:(填“>”或“<”)。(2)、氯化铍晶体易吸湿、水解、升华,可溶于有机溶剂。一定条件下有下列存在形式:

氯化铍晶体的晶体类型是 , 甲的空间构型是 , 乙中Be的杂化轨道类型是 , 从化学键角度分析形成丙的原因:。
(3)、是某些太阳能薄膜电池的材料,有人认为这种太阳能电池将取代硅基太阳能电池的统治地位。下图所示为的晶胞结构:
1、3号O的坐标分别为、(用分数坐标表示),与Ca等距离且最近的O有个,若的密度为 , 则阿伏加德罗常数=(列出计算式)。
17. 碲(Te)单质广泛应用于冶金等行业。用辉碲铋矿(主要成分为 , 含少量杂质CaO)为原料制取单质Te的工艺流程如下:
已知:25℃时的
回答下列问题:
(1)、烧渣的主要成分是 , 写出焙烧反应的化学方程式 , 气体Y不能排放到空气中,写出处理气体Y的一种方法。(2)、为提高烧渣碱浸速率,除将烧渣粉碎外,还可采取的措施是(写出1条)。(3)、Te位于元素周期表第ⅥA族,则碱浸后的滤液中Te的存在形式是(填粒子符号)。测得碱浸后的滤液中 , 向该滤液中加入NaF固体进行沉钙操作,则需最少加入gNaF达到沉钙完全。(溶液中的离子浓度时,可认为沉淀完全)(4)、反应1中氧化剂与还原剂的物质的量之比是。(5)、写出反应2的离子方程式。18. 三草酸合铁酸钾的化学式为 , 它是制备负载型活性铁催化剂的主要原料,也是有机反应的催化剂。实验室可采用下列装置(夹持仪器略)及方法制备该物质。
回答下列问题:
(1)、制备时,先使温度保持在40℃左右,然后将仪器(填仪器名称)中一定量的6%的溶液逐滴滴入到三颈烧瓶中,至溶液呈深棕色的浑浊状态时[其中含],再加入一定体积的溶液,逐滴加入至溶液为亮绿色,然后浓缩得晶体,选用的最佳浓缩方法是(填字母)。a.减压加热浓缩 b.高压加热浓缩 c.常压高温浓缩 d.常压常温浓缩
该制备方法中,溶液内生成的反应包括2个,化学方程式分别是、。
(2)、称量mg制备的三草酸合铁酸钾样品,将其溶解于水配制成稀溶液,然后再加少量稀硫酸。用标准溶液滴定该样品溶液,测定其中铁元素的质量分数。①所选取的滴定管种类及滴定管中溶液调节的位置合理的是(填字母),滴定终点的现象是。
a.酸式滴定管 0刻度 b.碱式滴定管 0刻度
c.酸式滴定管 0刻度以下某准确刻度 d.碱式滴定管 0刻度以下某准确刻度
②在配制的样品溶液中加入还原剂,将还原为 , 直至反应完全,过滤、洗涤。将滤液、洗涤液均转移到锥形瓶中,加稀硫酸,再用a溶液进行滴定,至终点时消耗VmL 标准溶液,该三草酸合铁酸钾样品中铁元素的质量分数的表达式为%。
19. 有机化合物G是抗炎症、抗肿瘤的药物。以有机化合物A和醛X为原料制备该药物的合成路线如下:
已知:Ⅰ.;
Ⅱ.R-COOH+R’-NH2
 +H2O;
+H2O;Ⅲ.R-CN

回答下列问题:
(1)、醛X的名称是 , F中的官能团名称是。(2)、C的结构简式是 , C生成D的反应类型是。(3)、E的同分异构体中,满足下列条件的同分异构体(不考虑立体异构)有种,其中有5种不同化学环境的H,且个数比为2∶2∶1∶1∶1的同分异构体的结构简式是。①含氰基 ②属于芳香族化合物 ③与溶液反应放出气体
(4)、写出以苯甲醇( )为原料制备
)为原料制备 的合成路线(其他无机试剂任选):。 20. 二氧化碳是一种温室气体,随着人类对化石燃料的使用量增大,温室效应加剧,威胁着人们的生存环境。利用工业生产的废气可制备二甲醚( , 简称DME)。以、为原料合成DME涉及的主要反应如下:
的合成路线(其他无机试剂任选):。 20. 二氧化碳是一种温室气体,随着人类对化石燃料的使用量增大,温室效应加剧,威胁着人们的生存环境。利用工业生产的废气可制备二甲醚( , 简称DME)。以、为原料合成DME涉及的主要反应如下:Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)、反应Ⅲ的 , 提高该反应中的平衡转化率的方法有(写出2条)。(2)、一定条件下,按不同的氢碳比向某恒压密闭容器中投料,发生反应,测得的平衡转化率随温度的变化如图所示:
已知:T℃时,反应Ⅱ的平衡常数;P点的选择性。
①则2(填“>”“=”或“<”);降低温度,的选择性降低,原因是。
②氢碳比为时,起始加入的物质的量为2mol,P点时容器容积为1.0L,此时的转化率为 , 容器中的浓度为。
③温度为T℃时反应Ⅰ的平衡常数(写计算式)。