辽宁省沈阳市2021-2022学年高三下学期第三次模拟考试化学试题
试卷更新日期:2022-06-23 类型:高考模拟
一、单选题
-
1. 化学科学在国防装备的打造中发挥着重要作用。下列有关叙述错误的是( )A、战机机身大量采用了碳纤维材料,对比传统金属材质,碳纤维密度小、强度高 B、隐形战机表面的吸波陶瓷——碳化硅属于分子晶体 C、曳光弹尾部的曳光剂中加入铜盐,曳光弹可发出绿光 D、涂在装甲车上的聚氨酯伪装涂料属于有机高分子材料2. 下列说法正确的是 ( )A、次氯酸的结构式为: B、虚线表示邻羟基苯甲醛的分子间氢键:
 C、醛基的碳氧双键有极性:
C、醛基的碳氧双键有极性: D、组成天然蛋白质的氨基酸可以表示为:
D、组成天然蛋白质的氨基酸可以表示为: 3. 为阿伏加德罗常数的值,下列说法正确的是 ( )A、反应中,每生成释放的中子数为 B、电解精炼铜时,若转移了个电子,阳极溶解铜 C、将一定量的通入溶液中,当有转化为时,转移电子总数为 D、标准状况下,庚烷中所含的分子数约为4. “冰墩墩”“雪容融”成为北京冬奥会的顶流,他们由、、和亚克力等环保材料制作而成。下列说法错误的是 ( )
3. 为阿伏加德罗常数的值,下列说法正确的是 ( )A、反应中,每生成释放的中子数为 B、电解精炼铜时,若转移了个电子,阳极溶解铜 C、将一定量的通入溶液中,当有转化为时,转移电子总数为 D、标准状况下,庚烷中所含的分子数约为4. “冰墩墩”“雪容融”成为北京冬奥会的顶流,他们由、、和亚克力等环保材料制作而成。下列说法错误的是 ( ) A、制作(
A、制作( )的单体可以使溴水褪色
B、(
)的单体可以使溴水褪色
B、( )中所有碳原子均可共面
C、的单体之一是苯乙烯,其碳的百分含量和乙炔相同
D、制备亚克力材料(
)中所有碳原子均可共面
C、的单体之一是苯乙烯,其碳的百分含量和乙炔相同
D、制备亚克力材料( )的单体是甲基丙烯酸甲酯
5. 下列实验方案合理的是 ( )
)的单体是甲基丙烯酸甲酯
5. 下列实验方案合理的是 ( )A
B
C
D




实验室模拟喷泉实验
实验室制备
蒸干溶液制固体
熔化固体
A、A B、B C、C D、D6. 中医经典方剂组合对新冠肺炎病毒治疗具有良好的效果。其中的一味中药黄芩的有效成分结构简式如图所示,下列说法错误的是 ( ) A、黄芩苷中含有4种含氧官能团 B、黄芩苷分子中苯环上的一氯代物有4种 C、黄芩苷能使酸性高锰酸钾溶液褪色 D、黄芩苷最多与生加成反应7. A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的变化情况如图所示,则下列说法中错误的是 ( )
A、黄芩苷中含有4种含氧官能团 B、黄芩苷分子中苯环上的一氯代物有4种 C、黄芩苷能使酸性高锰酸钾溶液褪色 D、黄芩苷最多与生加成反应7. A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的变化情况如图所示,则下列说法中错误的是 ( ) A、浓的D溶液在加热条件下可以与C发生反应 B、分子空间结构为三角锥形 C、B,D,E的单质或者化合物能作漂白剂 D、具有两性,既能和酸反应也能和碱反应8. 在一定条件下,取一定量的A和B在恒容密闭容器中发生反应:。达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断正确的是 ( )
A、浓的D溶液在加热条件下可以与C发生反应 B、分子空间结构为三角锥形 C、B,D,E的单质或者化合物能作漂白剂 D、具有两性,既能和酸反应也能和碱反应8. 在一定条件下,取一定量的A和B在恒容密闭容器中发生反应:。达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断正确的是 ( ) A、 B、E点的平衡常数小于F点的平衡常数 C、达到平衡后,增大A的浓度将会提高B的转化率 D、9. 海泥细菌通过消耗海底沉积层中的有机物获得营养,同时产生电子。科学家利用这一原理设计了海泥细菌电池,该技术既可在海底加速石油污染物降解速率,又可产生电能,有很好的应用前景。其中海泥代谢产物显酸性,电池工作原理如图所示。下列说法错误的是 ( )
A、 B、E点的平衡常数小于F点的平衡常数 C、达到平衡后,增大A的浓度将会提高B的转化率 D、9. 海泥细菌通过消耗海底沉积层中的有机物获得营养,同时产生电子。科学家利用这一原理设计了海泥细菌电池,该技术既可在海底加速石油污染物降解速率,又可产生电能,有很好的应用前景。其中海泥代谢产物显酸性,电池工作原理如图所示。下列说法错误的是 ( ) A、A电极的电势高于B电极 B、质子通过海底沉积层和海水层交接面,A电极消耗氧气(标准状况) C、负极的电极反应式为: D、海水和海泥作为电解质的一部分,富含盐分,导电性高,有利于输出电能10. 苯与的催化反应历程如图所示。关于该反应历程,下列说法错误的是 ( )
A、A电极的电势高于B电极 B、质子通过海底沉积层和海水层交接面,A电极消耗氧气(标准状况) C、负极的电极反应式为: D、海水和海泥作为电解质的一部分,富含盐分,导电性高,有利于输出电能10. 苯与的催化反应历程如图所示。关于该反应历程,下列说法错误的是 ( ) A、苯与的加成反应为吸热反应 B、除去产物溴苯中混有的一定量的溴,可以加氢氧化钠溶液,再通过分液的方法除去 C、苯与的催化反应决速步伴随着极性键的断裂与形成 D、从反应速率的角度分析,产物中取代产物占比更大11. 易溶于水,难溶于乙醇。从电镀污泥[含有、、、和等]中回收制备和其它金属的工艺流程如下,下列说法正确的是 ( )
A、苯与的加成反应为吸热反应 B、除去产物溴苯中混有的一定量的溴,可以加氢氧化钠溶液,再通过分液的方法除去 C、苯与的催化反应决速步伴随着极性键的断裂与形成 D、从反应速率的角度分析,产物中取代产物占比更大11. 易溶于水,难溶于乙醇。从电镀污泥[含有、、、和等]中回收制备和其它金属的工艺流程如下,下列说法正确的是 ( )
已知:萃取剂萃取的原理为。
A、“酸浸”时,为加快浸出速率,提高生产效益,可以使用浓硫酸 B、萃取余液可在酸浸中循环利用,反萃取剂X为 C、“反萃取”得到的溶液,在碱性条件下可被氧化生成 , 该反应的离子方程式为 D、溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作可得 , 向冷却结晶后的固液混合物中加入乙醇可提高产率12. 下列方程式正确的是 ( ) A、硫酸铜溶液中通入过量的氨气: B、如图电解质溶液 , 则正极电极反应式为: C、用可以除去溶液中的: D、电解饱和溶液:13. 以为催化剂催化还原氮氧化物已经大规模应用于烟气脱硝和柴油车尾气净化。为还原剂,氮氧化物在低温和高温时的反应原理不同,a表示低温下的反应原理,b表示高温下的反应原理,下列说法错误的是 ( )
A、硫酸铜溶液中通入过量的氨气: B、如图电解质溶液 , 则正极电极反应式为: C、用可以除去溶液中的: D、电解饱和溶液:13. 以为催化剂催化还原氮氧化物已经大规模应用于烟气脱硝和柴油车尾气净化。为还原剂,氮氧化物在低温和高温时的反应原理不同,a表示低温下的反应原理,b表示高温下的反应原理,下列说法错误的是 ( ) A、低温段反应每有参加反应转移电子 B、高温和低温时,催化剂中的化合价都发生了变化 C、在高温段反应中主要起到氧化的作用 D、高温和低温时,反应的总方程式都为14. 是一种重要的半导体材料,熔点为 , 密度为 , 其晶胞结构如图所示。已知阿伏加德罗常数的值为 , 的摩尔质量为 , 下列说法正确的是 ( )
A、低温段反应每有参加反应转移电子 B、高温和低温时,催化剂中的化合价都发生了变化 C、在高温段反应中主要起到氧化的作用 D、高温和低温时,反应的总方程式都为14. 是一种重要的半导体材料,熔点为 , 密度为 , 其晶胞结构如图所示。已知阿伏加德罗常数的值为 , 的摩尔质量为 , 下列说法正确的是 ( ) A、该晶体为离子晶体 B、的配位数为2 C、在元素周期表的第15纵列 D、的晶胞边长为15. 室温下,通过下列实验探究溶液的性质:
A、该晶体为离子晶体 B、的配位数为2 C、在元素周期表的第15纵列 D、的晶胞边长为15. 室温下,通过下列实验探究溶液的性质:编号
实验操作
1
用试纸测定的溶液,测得约为2
2
向的溶液中逐滴加入等体积的溶液,测得所得溶液的约为4
3
将酸性溶液与溶液混合,溶液褪色
下列说法正确的是( )
A、的约为 B、实验2溶液由2到4的过程中水的电离程度不断减小 C、实验2所得溶液中继续加溶液至溶液呈中性: D、实验3中酸性溶液褪色证明具有漂白性二、综合题
-
16. 央视报道《王者归“铼”》:我国利用新技术发现并提纯了超级金属“铼”,其熔点高、耐磨、耐腐蚀,可用来制造航空发动机核心部件,有塑打破美国垄断。工业上用富铼渣(含)制得铼粉,其工艺流程如图1所示:

回答下列问题:
(1)、铼()被称为类锰元素,与锰的价层电子结构相同,写出的价层电子排布式: , 已知元素锰与徕为同族元素,研究发现锰的熔点明显高于铼的熔点,其原因可能是。(2)、酸浸相同时间,测得徕的浸出率与温度关系如图2所示,分析时铼的浸出率最高的原因是;浸出反应中转化为两种强酸,请写出铼浸出反应的离子方程式。 (3)、图3表示萃取液流速与铼吸附率关系。结合实际工业生产效益,萃取液流速宜选用的范围是。
(3)、图3表示萃取液流速与铼吸附率关系。结合实际工业生产效益,萃取液流速宜选用的范围是。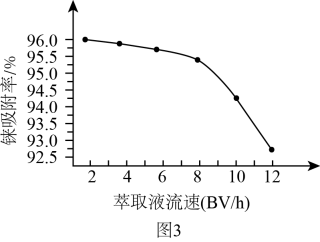 (4)、已知高铼酸铵微溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是。(5)、是酸性氧化物,与溶液反应的化学方程式为。(6)、整个工艺流程中可循环利用的物质有、。17. 亚硝酰氯()是一种红褐色液体或黄色气体,沸点为 , 遇水和潮气分解。请回答下列问题:(1)、与混合在通常条件下可反应得到。
(4)、已知高铼酸铵微溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是。(5)、是酸性氧化物,与溶液反应的化学方程式为。(6)、整个工艺流程中可循环利用的物质有、。17. 亚硝酰氯()是一种红褐色液体或黄色气体,沸点为 , 遇水和潮气分解。请回答下列问题:(1)、与混合在通常条件下可反应得到。①实验室制备的离子方程式是。
②选用如图所示的部分装置,欲用二氧化锰制备一瓶纯净且干燥的氯气,各玻璃导管接口连接顺序为(气流方向从左至右,每组仪器最多使用一次)。

③实验中“先通入 , 待反应装置中充满黄绿色气体时,再将缓缓通入”,此操作的目的是。
(2)、文献中记载的一种利用浓盐酸和浓溶液反应制取的原理及装置如图所示,反应原理:。
①仪器X为恒压滴液漏斗,用它代替分液漏斗优点是。
②若无干燥装置,会与水反应产生无色气体和白雾,且该气体在试管口变为红棕色,则发生反应的化学方程式为。
(3)、若用以下方法测定亚硝酰氯()纯度:取U形管中所得液体m克溶于水,配制成溶液,取出 , 以溶液为指示剂,用标准溶液滴定至终点,消耗标准溶液的体积为。已知:为不溶于水的砖红色沉淀;常温下 , 。①滴定时,应使用(填“酸式”或“碱式”)滴定管。
②滴定达到终点的标志是。
③亚硝酰氯()的质量分数为(用计算式表示即可)。
18. 甲基叔丁基醚()是一种高辛烷值汽油添加剂,可由甲醇和异丁烯(以表示)在催化剂作用下合成:。回答下列问题:(1)、反应过程中反应物首先被催化剂吸附,再经历过渡态,最终得到产物,相对能量与反应历程的关系如图所示(其中表示甲醇和异丁烯同时被吸附,表示甲醇先被吸附,表示异丁烯先被吸附),该反应的 , 下列说法错误的是。
A.三种反应历程中,反应速率最快
B.过渡态1比另两种过渡态稳定
C.降低温度和增大压强都有利于提高反应物平衡转化率
D.同温同压下,只要起始投料相同,相同时间三种途径的产率一定相同
(2)、向刚性密闭容器中充入等物质的量的甲醇和异丁烯,在催化剂作用下,分别在和两个温度反应,异丁烯的转化率随时间的变化关系如图所示。
①时,反应后到达点B,此时甲基叔丁基醚的体积分数为(保留3位有效数字)
②A、B、C三点中,正反应速率最大的是。
③比较A、B、C三点的平衡常数 , 从大到小的顺序是。
④已知对于反应 , 标准平衡常数 , 其中为各组分的平衡分压,分压=总压×该组分物质的量分数,。在时(如图),将等物质的量的甲醇和异丁烯充入恒容密闭容器中(初始压强为),甲醇的平衡分压为 , 反应的标准平衡常数。(保留1位小数)
19. 化合物M( )是合成药物的中间体,利用芳香化合物A制备化合物M的路线如下:
)是合成药物的中间体,利用芳香化合物A制备化合物M的路线如下: 
已知:Ⅰ.


 ;
;Ⅱ.
 (1)、D中的官能团名称。(2)、C的结构简式:。(3)、A到B的反应类型;F分子中最多个碳原子共平面。(4)、H生成M的化学方程式。(5)、Z是E的同分异构体,满足下列条件的Z的结构有种;写出一种核磁共振氢谱有3组峰的结构简式。
(1)、D中的官能团名称。(2)、C的结构简式:。(3)、A到B的反应类型;F分子中最多个碳原子共平面。(4)、H生成M的化学方程式。(5)、Z是E的同分异构体,满足下列条件的Z的结构有种;写出一种核磁共振氢谱有3组峰的结构简式。①含有且与苯环相连 ②能发生银镜反应
(6)、利用有机物Q经过催化氧化和已知Ⅱ两步制备有机物P( ),请写出Q的结构简式。
),请写出Q的结构简式。