天津市滨海新区2022届普通高考模拟试卷化学试题
试卷更新日期:2022-06-23 类型:高考模拟
一、单选题
-
1. 化学与生活、生产密切相关。下列说法中错误的是( )A、市面上的防晒衣通常采用聚酯纤维材料制作,忌长期用肥皂洗涤 B、“天和”核心舱其腔体使用的氮化硼陶瓷基复合材料属于无机非金属材料 C、制作“嫦娥”太空飞行器使用的碳纤维复合材料是一种新型有机高分子材料 D、“凡引水种盐,待夏秋之交,南风大起,则一宵结成”该过程属于蒸发结晶2. 下列说法一定错误的是( )A、乙烯分子中的π键:
 B、Se是人体必需的微量元素,和互为同位素
C、原子结构示意图
B、Se是人体必需的微量元素,和互为同位素
C、原子结构示意图 既可以表示 , 也可以表示
D、(核磁共振)可用于含碳化合物的结构分析,的中子数为6
3. 下列说法中正确的是( )A、氢键仅存在于分子间 B、和晶体类型相同 C、的沸点比CO低主要是由于范德华力不同 D、溶于水和干冰升华都只有范德华力改变4. SO2既是大气主要污染物之一,又在生产生活中具有广泛应用,如可生产SO3并进而制得硫酸等,其反应原理为:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1。实验室可用铜和浓硫酸制取SO2。对于反应2SO2(g)+O2(g) 2SO3(g),下列说法正确的是( )A、该反应在任何条件下都能自发进行 B、反应达平衡后再通入O2 , SO3的体积分数一定增加 C、反应在高温、催化剂条件下进行可提高SO2的平衡转化率 D、2 mol SO2(g)和1 mol O2(g)所含键能总和比2 mol SO3(g)所含键能小5. 对于下列过程,能正确描述其反应的相应方程式的是( )A、双氧水长期放置: B、向溶液滴入过量NaOH溶液: C、将溶液滴入酸性溶液: D、向次氯酸钙溶液中通入少量气体:6. 2021年诺贝尔化学奖授予本杰明。李斯特、大卫·麦克米兰,以表彰在“不对称有机催化的发展”中的贡献,用脯氨酸催化合成酮醛反应如图:
既可以表示 , 也可以表示
D、(核磁共振)可用于含碳化合物的结构分析,的中子数为6
3. 下列说法中正确的是( )A、氢键仅存在于分子间 B、和晶体类型相同 C、的沸点比CO低主要是由于范德华力不同 D、溶于水和干冰升华都只有范德华力改变4. SO2既是大气主要污染物之一,又在生产生活中具有广泛应用,如可生产SO3并进而制得硫酸等,其反应原理为:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1。实验室可用铜和浓硫酸制取SO2。对于反应2SO2(g)+O2(g) 2SO3(g),下列说法正确的是( )A、该反应在任何条件下都能自发进行 B、反应达平衡后再通入O2 , SO3的体积分数一定增加 C、反应在高温、催化剂条件下进行可提高SO2的平衡转化率 D、2 mol SO2(g)和1 mol O2(g)所含键能总和比2 mol SO3(g)所含键能小5. 对于下列过程,能正确描述其反应的相应方程式的是( )A、双氧水长期放置: B、向溶液滴入过量NaOH溶液: C、将溶液滴入酸性溶液: D、向次氯酸钙溶液中通入少量气体:6. 2021年诺贝尔化学奖授予本杰明。李斯特、大卫·麦克米兰,以表彰在“不对称有机催化的发展”中的贡献,用脯氨酸催化合成酮醛反应如图:
下列说法错误的是( )
A、c可发生消去反应形成双键 B、该反应原子利用率100% C、脯氨酸与 互为同分异构体
D、a、b、c均可使酸性高锰酸钾溶液褪色
7. 用表示阿伏加德罗常数的值,下列说法正确的是( )A、中所含电子的数目为4.5 B、由乙烯制备一氯乙烷,若获得1mol产品需2个分子 C、常温下,pH=3的溶液中,由水电离的数为0.001 D、标准状况下,22.4L与足量水反应可获得个分子8. 下列实验对应的结论正确的是( )
互为同分异构体
D、a、b、c均可使酸性高锰酸钾溶液褪色
7. 用表示阿伏加德罗常数的值,下列说法正确的是( )A、中所含电子的数目为4.5 B、由乙烯制备一氯乙烷,若获得1mol产品需2个分子 C、常温下,pH=3的溶液中,由水电离的数为0.001 D、标准状况下,22.4L与足量水反应可获得个分子8. 下列实验对应的结论正确的是( )选项
A
B
C
D
实验


有白色沉淀产生

均有白色沉淀

结论
正反应放热
白色沉淀一定是BaSO3
待测液中含有Cl-和
Ag+与Fe2+不反应
A、A B、B C、C D、D9. 已知W、X、Y、Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( ) A、电负性:Z<Y B、简单离子半径:Z>Y>W>X C、元素W形成的某阳离子空间构型为正四面体 D、化合物中含有极性共价键和非极性共价键10. 联氨可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。
A、电负性:Z<Y B、简单离子半径:Z>Y>W>X C、元素W形成的某阳离子空间构型为正四面体 D、化合物中含有极性共价键和非极性共价键10. 联氨可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。
下列叙述错误的是( )
A、1mol可处理水中1.5molO2 B、③中发生反应后溶液的pH增大 C、①转化中失去电子 D、工业上也可用处理锅炉水中的溶解氧11. 南京大学开发出一种以太阳能驱动的恒流电解装置,成功实现了从海水中提取金属锂,其工作原理如图。下列说法错误的是( ) A、工作时的能量转化形式:太阳能→化学能→电能 B、铜箔为阴极,发生还原反应 C、阳极区可能有和生成 D、固体陶瓷膜可让海水中选择性通过12. 甘氨酸盐酸盐的水溶液呈酸性,溶液中存在以下平衡:
A、工作时的能量转化形式:太阳能→化学能→电能 B、铜箔为阴极,发生还原反应 C、阳极区可能有和生成 D、固体陶瓷膜可让海水中选择性通过12. 甘氨酸盐酸盐的水溶液呈酸性,溶液中存在以下平衡:常温时,向10mL一定浓度的的水溶液中滴入同浓度的NaOH溶液。混合溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是( )
 A、水的电离程度:Q>X B、X→P过程中:逐渐增大 C、P点的溶液中: D、当时,混合溶液中的溶质主要为和NaCl
A、水的电离程度:Q>X B、X→P过程中:逐渐增大 C、P点的溶液中: D、当时,混合溶液中的溶质主要为和NaCl二、综合题
-
13. 含镓(Ga)化合物在半导体材料、医药行业等领域发挥重要作用。回答下列问题:(1)、基态Ga原子价电子的轨道表示式为。(2)、Ga与Zn的第一电离能大小关系为:GaZn(填“>”“<”或“=”)。(3)、的熔沸点如下表所示。
镓的卤化物
熔点/℃
77.75
122.3
211.5
沸点/℃
201.2
279
346
①100℃,、和呈液态的是(填化学式)。
②的熔点约1000℃,远高于的熔点,原因是。
(4)、镓配合物具有高的反应活性和良好的选择性在药物领域得到广泛的关注。与2-甲基-8-羟基喹啉(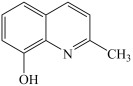 )在一定条件下反应可以得到喹啉类家配合物,2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为。 (5)、作为第二代半导体,砷化家单晶因其价格昂贵而素有“半导体贵族”之称。砷化镓是由和在一定条件下制备得到,同时得到另一物质,该物质分子是(填“极性分子”或“非极性分子”),分子的空间形状为。(6)、锰与镓同周期,催化分解: , 其反应机理如图:
)在一定条件下反应可以得到喹啉类家配合物,2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为。 (5)、作为第二代半导体,砷化家单晶因其价格昂贵而素有“半导体贵族”之称。砷化镓是由和在一定条件下制备得到,同时得到另一物质,该物质分子是(填“极性分子”或“非极性分子”),分子的空间形状为。(6)、锰与镓同周期,催化分解: , 其反应机理如图: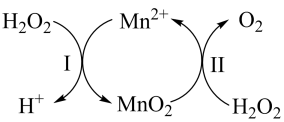
已知反应Ⅱ为: , 写出反应Ⅰ的热化学方程式(焓变用和表示):。
(7)、钙与镓同周期,晶胞结构见图,则距最近且等距的有个。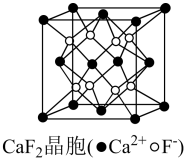 14. 乙肝新药的中间体化合物J的一种合成路线如图:
14. 乙肝新药的中间体化合物J的一种合成路线如图:
已知:RCOOH

回答下列问题:
(1)、A的化学名称为。(2)、D中含氧官能团的名称为。(3)、反应②中还有HBr生成,则M的结构简式为。(4)、写出反应③的化学方程式。(5)、由G生成J的过程中,设计反应④和反应⑤的目的是。(6)、化合物Q是A的同系物,相对分子质量比A的多14;化合物Q的同分异构体中,同时满足下列条件的共有种(不考虑立体异构)。条件:①与FeCl3溶液发生显色反应;②能发生银镜反应;③苯环上取代基数目小于4。
其中,核磁共振氢谱有五组峰,且峰面积之比为2∶2∶1∶1∶1的结构简式为。
(7)、根据上述信息,以 和
和 为原料,设计合成
为原料,设计合成 的路线(无机试剂任选)。 15. 和焦亚硫酸钠可用作食品添加剂。回答下列问题:(1)、实验室用和制取的化学方程式为。欲净化与收集 , 选择必要装置,按气流方向连接顺序为(填仪器接口的字母编号)。
的路线(无机试剂任选)。 15. 和焦亚硫酸钠可用作食品添加剂。回答下列问题:(1)、实验室用和制取的化学方程式为。欲净化与收集 , 选择必要装置,按气流方向连接顺序为(填仪器接口的字母编号)。 (2)、①焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。已知:。
(2)、①焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。已知:。试剂:稀盐酸、稀、稀、溶液、酸性溶液、溶液
实验编号
实验步骤
现象
结论
Ⅰ
取少量样品,加入除氧蒸馏水
固体完全溶解得到无色溶液
/
Ⅱ
取实验Ⅰ的溶液,
样品已氧化变质
Ⅲ
另取实验Ⅰ的溶液,加入酸性KMnO4溶液
溶液褪色
样品未完全氧化变质
②是常用的食品添加剂,常用于葡萄酒、果脯、拉面等食品中。为检验某白葡萄酒中是否含有能否用酸性溶液检验?作出判断并说明理由。
(3)、某小组利用下列装置测定空气中的含量。
通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是;该装置中发生的离子方程式为:。若空气流速为 , 当观察到时,结束计时,测定耗时t min。假定样品中的可被溶液充分吸收,该空气样品中的含量是。
16. 汽车尾气中含有氨氧化合物、和CO等,减少它们在大气中的排放是环境保护的重要内容之一。 (1)、一定条件,反应的反应历程如图所示,该历程分步进行,其中第步是决速步骤。(2)、在恒温恒容密闭容器中进行上述反应,原料组成 , 体系达到平衡时的体积分数为25%,则CO的平衡转化率=。(3)、氮的氧化物脱除可用电化学原理处理,如下图装置可同时吸收和NO。已知:是一种弱酸。直流电源的正极为(填“a”或“b”),阴极的电极反应式。该电解装置选择(填“阳”或“阴”)离子交换膜。
(1)、一定条件,反应的反应历程如图所示,该历程分步进行,其中第步是决速步骤。(2)、在恒温恒容密闭容器中进行上述反应,原料组成 , 体系达到平衡时的体积分数为25%,则CO的平衡转化率=。(3)、氮的氧化物脱除可用电化学原理处理,如下图装置可同时吸收和NO。已知:是一种弱酸。直流电源的正极为(填“a”或“b”),阴极的电极反应式。该电解装置选择(填“阳”或“阴”)离子交换膜。
中国提出要实现“二氧化碳排放力争于2030年前达到峰值,争取在2060年前实现碳中和”的目标,二氧化碳的资源化利用对实现碳中和目标具有促进作用。
(4)、在一定条件下,向体积为2L的恒容密闭容器中通入1mol和3mol , 发生反应 , 测得和随时间变化如图所示。
①M点时,。(填“>”、“<”或“=”)
②下列叙述中一定能说明该反应达到平衡状态的是。
A.化学反应速率关系:
B.容器内混合气体的密度不再改变
C.单位时间内,每断裂2个C=O键,同时断裂3个O-H键
D.容器内混合气体的平均摩尔质量不再改变