河北省沧州市2022届高三下学期二模化学试题
试卷更新日期:2022-06-23 类型:高考模拟
一、单选题
-
1. 《天工开物·作咸》中记载了天然气的开发和利用,“西川有火井,事奇甚,其井居然冷水,绝无火气,但以长竹剖开去节,合缝漆布,一头插入井底,其上曲接,以口紧对釜脐,注卤水釜中,只见火意烘烘,水即滚沸”。下列说法错误的是( )A、天然气的主要成分属于温室气体 B、海底可燃冰的成分为CH4·nH2O C、天然气属于化石能源 D、天然气燃烧时化学能全部转化为热能2. 有效地将O2从稳定的基态激活到活性氧的高能态是科学家们近几十年来一直在探索的重要科学问题。一种策略是通过连续的单电子转移过程,依次形成超氧自由基(· )、过氧化阴离子()和羟基自由基(·OH),称为电子转移机制。下列说法正确的是( )A、O2、·、互为同素异形体 B、的电子式为:
 C、·OH与H2O电子数相同
D、O2只含有共价键,是共价化合物
3. 作为我国将“碳达峰、碳中和”纳人生态文明建设整体布局后的首个世界级体育盛会,北京2022年冬奥会向世界展现了我国的科技实力。下列说法错误的是( )A、速滑运动员佩戴的头盔使用的碳纤维属于无机材料 B、可穿戴式智能测温设备“测温创可贴”的测温芯片主要成分是二氧化硅 C、二氧化碳取代氟利昂作为制冷剂,对保护臭氧层作出重要贡献 D、可降解餐具的原料玉米淀粉、甘蔗渣的主要成分都属于糖类4. 下列操作规范且能达到实验目的的是( )
C、·OH与H2O电子数相同
D、O2只含有共价键,是共价化合物
3. 作为我国将“碳达峰、碳中和”纳人生态文明建设整体布局后的首个世界级体育盛会,北京2022年冬奥会向世界展现了我国的科技实力。下列说法错误的是( )A、速滑运动员佩戴的头盔使用的碳纤维属于无机材料 B、可穿戴式智能测温设备“测温创可贴”的测温芯片主要成分是二氧化硅 C、二氧化碳取代氟利昂作为制冷剂,对保护臭氧层作出重要贡献 D、可降解餐具的原料玉米淀粉、甘蔗渣的主要成分都属于糖类4. 下列操作规范且能达到实验目的的是( )A
B
C
D




测定维生素C浓度
除去H2S气体中的HCl杂质
在铁上镀铜
实验室制备并收集氨气
A、A B、B C、C D、D5. 以NA表示阿伏加德罗常数的值,下列说法正确的是( )A、用惰性电极电解足量CuSO4溶液,当阴极增重6.4g时,转移电子数为0.2NA B、标准状况下,2.24 L HF含有质子数为NA C、1molN2与3molH2在一定条件下充分反应后所得体系中含有N-H键数目为6NA D、室温下,1 L pH=7的CH3COONH4溶液中发生电离的H2O分子数目为10-7NA6. 苧烯又称苎烯,有类似柠檬的香味,广泛存在于天然的植物精油中,其结构简式如图所示。关于该化合物,下列说法正确的是( ) A、分子式为C10H14 B、分子中所有碳原子可能共平面 C、可以发生取代反应、加成反应 D、不能使酸性高锰酸钾溶液褪色7. 氧化锆是一种高级耐火材料,氧化钇主要用作制造微波用磁性材料。一种利用玻璃窑炉替换下的锆废砖(主要成分ZrO2、Y2O3、CaO等)提纯氧化锆和氧化钇的工艺流程如下:
A、分子式为C10H14 B、分子中所有碳原子可能共平面 C、可以发生取代反应、加成反应 D、不能使酸性高锰酸钾溶液褪色7. 氧化锆是一种高级耐火材料,氧化钇主要用作制造微波用磁性材料。一种利用玻璃窑炉替换下的锆废砖(主要成分ZrO2、Y2O3、CaO等)提纯氧化锆和氧化钇的工艺流程如下:
下列说法正确的是( )
A、“酸化”是锆废砖粉和硫酸在硫酸铵催化作用下进行的焙烧反应,硫酸适宜用盐酸代替 B、“中和1”发生反应的离子方程式为Zr4+ +4OH- =Zr(OH)4 ↓ C、实验室模拟“焙烧”时使用的硅酸盐仪器只有烧杯和酒精灯 D、滤液2可以处理后返回“酸化”使用,实现循环8. 火星大气约95%是CO2 , Li-CO2电池在未来的火星探测领域有着重要的应用前景。科学家设计了一系列Ru/M-CPY@ CNT(碳纳米管)杂化材料(M = Co、Zn、Ni、Mn, CNTs碳纳米管是一种电导率高、比表面积大、通道和孔隙率丰富的导电基底)作为电极。已知该电池放电时的反应为4Li+3CO2=2Li2CO3+C,下列说法错误的是( ) A、放电时,Li电极作电池负极,有电子经导线流出 B、充电时,每转移1mol电子,两电极的质量变化差值为7g C、充电时,阳极的电极反应式为C-4e-+2Li2CO3 =3CO2↑+4Li+ D、杂化材料中CNTs增多了CO2的吸附位点,可使该电池表现出优异的电化学性能9. 环氧丙烷(C3H6O,PO)是一种重要的有机化工产品,对Cu2O催化剂表面催化空气氧化丙烯反应机理的DFT计算表明,可能有通过分子氧(甲图)和晶格氧(乙图)两种反应机理(TS代表中间态)。已知吸附能指在吸附过程中释放的能量,下列说法错误的是中( )
A、放电时,Li电极作电池负极,有电子经导线流出 B、充电时,每转移1mol电子,两电极的质量变化差值为7g C、充电时,阳极的电极反应式为C-4e-+2Li2CO3 =3CO2↑+4Li+ D、杂化材料中CNTs增多了CO2的吸附位点,可使该电池表现出优异的电化学性能9. 环氧丙烷(C3H6O,PO)是一种重要的有机化工产品,对Cu2O催化剂表面催化空气氧化丙烯反应机理的DFT计算表明,可能有通过分子氧(甲图)和晶格氧(乙图)两种反应机理(TS代表中间态)。已知吸附能指在吸附过程中释放的能量,下列说法错误的是中( )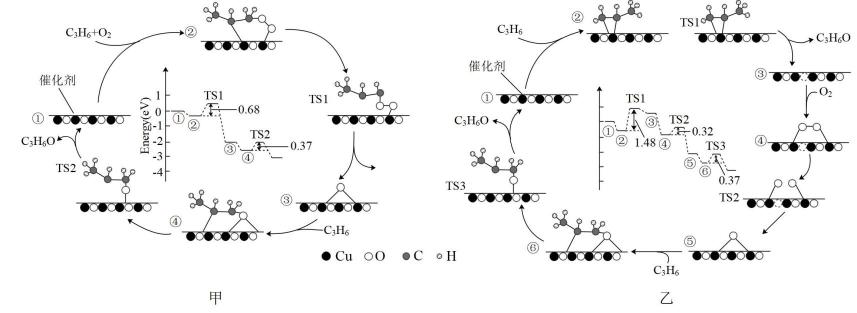 A、C3H6在催化剂上的吸附能低于C3H6与O2共吸附在表面的吸附能 B、空气氧化丙烯生成环氧丙烷是放热反应 C、通过对图像的分析得出,该反应更易按照甲图路径进行 D、总反应方程式为2C3H6+O22C3H6O10. 香豆酸主要分布在禾本科植物的茎干中,其结构如图所示,下列说法错误的是( )
A、C3H6在催化剂上的吸附能低于C3H6与O2共吸附在表面的吸附能 B、空气氧化丙烯生成环氧丙烷是放热反应 C、通过对图像的分析得出,该反应更易按照甲图路径进行 D、总反应方程式为2C3H6+O22C3H6O10. 香豆酸主要分布在禾本科植物的茎干中,其结构如图所示,下列说法错误的是( ) A、可以使溴水褪色 B、1mol该物质最多可与2molH2发生加成反应 C、该物质存在可以发生银镜反应的芳香族化合物同分异构体 D、等物质的量的香豆酸分别与Na、NaOH反应,消耗两者的物质的量之比为1:211. 常温下,用NaOH溶液滴定二元弱酸亚磷酸溶液,溶液中-和-lgc( )或-和-lgc( )的关系如图所示,下列说法错误的是( )
A、可以使溴水褪色 B、1mol该物质最多可与2molH2发生加成反应 C、该物质存在可以发生银镜反应的芳香族化合物同分异构体 D、等物质的量的香豆酸分别与Na、NaOH反应,消耗两者的物质的量之比为1:211. 常温下,用NaOH溶液滴定二元弱酸亚磷酸溶液,溶液中-和-lgc( )或-和-lgc( )的关系如图所示,下列说法错误的是( ) A、L2表示-和-lgc( )的关系 B、H3PO3的电离常数Ka1(H3PO3)的数量级为10-2 C、等浓度等体积的H3PO3溶液与NaOH溶液充分混合,c( )<c(H3PO3) D、pH=6.54时,c(Na+ )<3c()
A、L2表示-和-lgc( )的关系 B、H3PO3的电离常数Ka1(H3PO3)的数量级为10-2 C、等浓度等体积的H3PO3溶液与NaOH溶液充分混合,c( )<c(H3PO3) D、pH=6.54时,c(Na+ )<3c()二、多选题
-
12. 一种工业洗涤剂中间体结构式如图所示,其中短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,Y和Q最外层电子数之和是Z原子L层电子数的二倍,下列说法正确的是( )
 A、X、Z、Q、W均可与Y形成二元化合物 B、简单离子半径:W>Z>Y C、Y的简单氢化物的稳定性和沸点都高于Z的简单氢化物 D、将W与O2反应后的固体放入水中,观察是否产生气体,即可判断氧化产物种类13. 下列实验方案、现象和结论都正确的是( )
A、X、Z、Q、W均可与Y形成二元化合物 B、简单离子半径:W>Z>Y C、Y的简单氢化物的稳定性和沸点都高于Z的简单氢化物 D、将W与O2反应后的固体放入水中,观察是否产生气体,即可判断氧化产物种类13. 下列实验方案、现象和结论都正确的是( )选项
目的
实验方案
现象和结论
A
探究铁粉和水蒸气反应的气体产物
将产生的气体通入肥皂水中,用燃着的木条靠近产生的气泡,观察现象
气泡破裂发出爆鸣声,说明生成的是H2
B
探究浓度对反应速率的影响
向两支各装有4 mL 0.01 mol·L-1的酸性KMnO4溶液的试管中,分别加入0.1 mol·L-1的H2C2O4溶液2 mL和4mL,记录溶液褪色时间
加入草酸量多的试管褪色快,说明浓度越大反应速率越快
C
探究HClO和
CH3COOH酸性强弱
取等浓度的NaClO溶液和CH3COONa 溶液,分别用 pH试纸测量,与标准比色卡对照
CH3COONa溶液的pH较小,说明酸性:CH3COOH> HClO
D
探究AgCl和AgI的Ksp大小
向等浓度的NaCl和KI混合溶液中逐滴加入AgNO3溶液,观察沉淀颜色
先产生黄色沉淀,说明Ksp(AgCl)> Ksp (AgI)
A、A B、B C、C D、D三、综合题
-
14. 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)、提高“酸浸”速率的方法有。(任写一条)(2)、“滤渣1”的主要成分是。(写化学式)(3)、黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12 , “除铁”的离子方程式为。(4)、“除钙镁”时,随pH降低,NaF用量急剧增加,原因是(结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F- )最小为mol·L-1。(已知离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全,Ksp(CaF2)=1.0 ×10-10 , Ksp(MgF2)=7.5×10-11)(5)、镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为、。 (6)、获得NiSO4(s)的“一系列操作”是。(7)、工艺流程中,可循环利用的物质是。15. 山梨酸钾是一种低毒、安全、高效的食品防腐剂,具有非常强的抑制霉菌与腐败菌的作用。一种制备方法如下:
(6)、获得NiSO4(s)的“一系列操作”是。(7)、工艺流程中,可循环利用的物质是。15. 山梨酸钾是一种低毒、安全、高效的食品防腐剂,具有非常强的抑制霉菌与腐败菌的作用。一种制备方法如下:
名称
分子式
分子量
熔点(℃)
沸点(℃)
性质
山梨酸钾
C6H7O2 K
150
270(分解)
—
易溶于水和乙醇
山梨酸
C6H8O2
112
132
228
微溶于水,易溶于有机溶剂
巴豆醛
C4 H6O
70
-76.5
104
微溶于水,可溶于有机溶剂
丙二酸
C3H4O4
104
135
140(分解)
易溶于水,与有机物可混溶
吡啶
C5H5N
79
-41.6
115.3
显碱性,可与山梨酸反应
(1)、I.制备山梨酸钾:步骤1:在如图所示的反应装置中,加入5 g巴豆醛、10 g丙二酸和1 g吡啶,室温搅拌20分钟。

步骤2:缓慢升温至95 ℃,保温95~100 ℃反应3~4小时,待CO2放出后,用冰水浴降温至10℃以下,缓慢加入10%的稀硫酸,控制滴加速度使温度低于20℃,至pH约为4~5为止。
步骤3:冷冻过夜,抽滤,结晶用冰水洗涤,得山梨酸粗品。在95~100 ℃水浴中,用60%乙醇溶解,抽滤,母液在-10~5℃下结晶,得山梨酸纯品。
步骤4:将山梨酸纯品、KOH、乙醇按2:1:8.6(质量比)倒入烧瓶中,并加入少量水,在60~70 ℃水浴中搅拌,回流至反应液透明,迅速在冰水浴中冷却,所得晶体抽滤并烘干,即可得白色山梨酸钾晶体。
仪器A的名称是;从平衡移动的角度解释“步骤1”中加入吡啶的作用。
(2)、“步骤2”中的加热方式采用油浴,不采用水浴,原因是;加入稀硫酸将pH调至4~5的目的是。(3)、由山梨酸粗品制得纯品的提纯方法是。(4)、若最终制得3.0 g山梨酸钾晶体,则产率为%。(5)、II.测定食品中山梨酸钾含量(杂质不参与反应):取待测食品m g,将其中的山梨酸钾浓缩、提取后,用盐酸酸化得白色晶体。将白色晶体用试剂X溶解后,配成250mL溶液。取25mL配好的溶液,以酚酞为指示剂,用cmol·L-1的标准NaOH溶液滴定,三次平行实验测得消耗标准液的平均体积为V mL。
①溶解白色晶体的试剂X可选用;(填选项序号)
A.蒸馏水 B.乙醇 C.稀盐酸
②待测食品中山梨酸钾的质量分数为%。(用含字母的代数式表示)
16. 由于油价飙升、能源多样化和能源供应安全需求,以及全球环境问题,使天然气成为一种全球性的能源,也使氢气被视为未来的能源媒介。国际上最为有效的制氢工艺是甲烷水蒸气重整反应,涉及的主要反应如下:反应I:CH4(g)+ H2O(g) CO(g) +3H2(g) △H1=+206 kJ·mol-1
反应II:CH4(g)+ 2H2O(g) CO2(g)+4H2(g) △H2=+165 kJ·mol-1
反应III:CO(g)+ H2O(g) CO2(g)+H2(g) △H3
回答下列问题:
(1)、△H3=。已知(R、C为常数),反应I、II、III的平衡常数与温度T的变化关系如图甲所示,其中表示反应II的是曲线(填标号)。 (2)、不同压强下,将甲烷和水蒸气按照物质的量之比为1:3的比例投料,测得平衡状态下某物质随温度的变化如图乙所示。图中纵坐标可以表示(填“CH4转化率”或“CO2物质的量分数”),压强p1、p2、p3由大到小的顺序是。
(2)、不同压强下,将甲烷和水蒸气按照物质的量之比为1:3的比例投料,测得平衡状态下某物质随温度的变化如图乙所示。图中纵坐标可以表示(填“CH4转化率”或“CO2物质的量分数”),压强p1、p2、p3由大到小的顺序是。 (3)、一定条件下,向恒容容器中以物质的量之比为1:3的比例投入甲烷和水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则H2的物质的量分数x(H2)= , 反应III以物质的量分数表示的平衡常数Kx=。 (可用分数表示)(4)、一种高性能甲烷燃料电池的工作原理如图丙所示,使用特定催化剂只发生反应I,以熔融碳酸盐(MCO3)为电解质,燃料电池负极的电极反应式为 。
(3)、一定条件下,向恒容容器中以物质的量之比为1:3的比例投入甲烷和水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则H2的物质的量分数x(H2)= , 反应III以物质的量分数表示的平衡常数Kx=。 (可用分数表示)(4)、一种高性能甲烷燃料电池的工作原理如图丙所示,使用特定催化剂只发生反应I,以熔融碳酸盐(MCO3)为电解质,燃料电池负极的电极反应式为 。 17. 氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型的非金属元素到典型的金属元素的一个完整的过渡。(1)、下列氮原子的能量最低的是____。A、
17. 氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型的非金属元素到典型的金属元素的一个完整的过渡。(1)、下列氮原子的能量最低的是____。A、 B、
B、 C、
C、 D、
D、 (2)、①氮族元素简单氢化物的键角NH3>PH3>AsH3 , 其原因是。
(2)、①氮族元素简单氢化物的键角NH3>PH3>AsH3 , 其原因是。②南开大学某课题组成功合成了无机二茂铁类似物[Fe(η4- P4)2]2-。环状是芳香性π配体,P的杂化方式是 ,中的大π键应表示为(分子中的大π键可用符号表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)
 (3)、雌黄的分子式为As2S3 , 1个As2S3分子中孤电子对数目为。(4)、天津理工大学科研团队制备出一种智能离子交换剂,由平行堆积的一维链阴离子(部分结构如下图)和K+阳离子组成,含有n个最简单元的阴离子可表示为。
(3)、雌黄的分子式为As2S3 , 1个As2S3分子中孤电子对数目为。(4)、天津理工大学科研团队制备出一种智能离子交换剂,由平行堆积的一维链阴离子(部分结构如下图)和K+阳离子组成,含有n个最简单元的阴离子可表示为。 (5)、①基态铋原子的价电子排布式为。
(5)、①基态铋原子的价电子排布式为。②铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为a pm,阿伏加德罗常数为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。
 18. 盐酸安罗替尼是一种小分子多靶点酪氨酸激酶抑制剂,具有抗肿瘤血管生成和抑制肿瘤生长的作用,其合成路线如下:
18. 盐酸安罗替尼是一种小分子多靶点酪氨酸激酶抑制剂,具有抗肿瘤血管生成和抑制肿瘤生长的作用,其合成路线如下:
已知信息:
i.

ii.羰基与烯醇存在互变异构:

回答下列问题:
(1)、A中官能团的名称为。(2)、B有多种同分异构体,其中能同时满足下列条件的化合物的结构简式为、。(不考虑立体异构)①不存在环状结构;
②可发生水解反应、加聚反应,也能与新制氢氧化铜悬浊液反应生成砖红色沉淀;
③核磁共振氢谱有两组峰,峰面积之比为1:3。
(3)、D的结构简式为 , D→E的反应条件为。(4)、F→G的反应方程式为。(5)、H→I的反应类型为。(6)、设计由苯甲酸甲酯制备甲酸苯甲酯的合成路线(无机试剂任选)。