江苏省南通市2022届高三第四次模拟考试化学试题
试卷更新日期:2022-06-23 类型:高考模拟
一、单选题
-
1. 2022年北京冬奥会火炬使用聚硅氮烷树脂和碳纤维合成的复合材料作外壳,并以氢气为燃料,体现了科技、绿色、低碳等特点。下列说法正确的是( )
 A、该复合材料有密度大、熔点低的特点 B、聚硅氮烷树脂和碳纤维都属于纯净物 C、燃烧时氢气与氧气发生氧化还原反应 D、可用如图表示氢气燃烧的能量变化2. 侯氏制碱法涉及反应:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓。下列说法正确的是( )A、基态碳原子的轨道表示式:
A、该复合材料有密度大、熔点低的特点 B、聚硅氮烷树脂和碳纤维都属于纯净物 C、燃烧时氢气与氧气发生氧化还原反应 D、可用如图表示氢气燃烧的能量变化2. 侯氏制碱法涉及反应:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓。下列说法正确的是( )A、基态碳原子的轨道表示式: B、NH3中只存在极性共价键
C、NH4Cl的电子式:
B、NH3中只存在极性共价键
C、NH4Cl的电子式: D、NaHCO3的电离方程式:NaHCO3=Na++H++CO
3. 前四周期元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物水溶液呈碱性,Y的原子核外有2个未成对电子,Z的单质燃烧时火焰呈黄色,W的原子序数是Y的两倍,Q的最外层有一个电子且内层轨道全充满。下列说法正确的是( )A、第一电离能:I1(Y)>I1(X)>I1(W) B、Q元素位于第四周期IA族 C、原子半径:r(Z)>r(W)>r(Y) D、W的简单气态氢化物的稳定性比Y的强4. 下列有关物质的性质与用途具有对应关系的是( )A、晶体Si熔点高,可用作计算机芯片 B、NH4HCO3受热易分解,可用作氮肥 C、SO2具有还原性,可用于漂白纸浆 D、Al(OH)3能与酸反应,可用作抗胃酸药5. NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。下列说法正确的是( )A、新制氯水需存放在带玻璃塞的棕色试剂瓶中 B、可用广泛pH试纸测定新制氯水的pH值 C、NaClO与CO2反应的离子方程式为NaClO+CO2+H2O=HClO+Na++HCO D、使用NaClO消毒时,可用盐酸酸化6. NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。实验室用如图所示方法制备ClO2水溶液,下列说法错误的是( )
D、NaHCO3的电离方程式:NaHCO3=Na++H++CO
3. 前四周期元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物水溶液呈碱性,Y的原子核外有2个未成对电子,Z的单质燃烧时火焰呈黄色,W的原子序数是Y的两倍,Q的最外层有一个电子且内层轨道全充满。下列说法正确的是( )A、第一电离能:I1(Y)>I1(X)>I1(W) B、Q元素位于第四周期IA族 C、原子半径:r(Z)>r(W)>r(Y) D、W的简单气态氢化物的稳定性比Y的强4. 下列有关物质的性质与用途具有对应关系的是( )A、晶体Si熔点高,可用作计算机芯片 B、NH4HCO3受热易分解,可用作氮肥 C、SO2具有还原性,可用于漂白纸浆 D、Al(OH)3能与酸反应,可用作抗胃酸药5. NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。下列说法正确的是( )A、新制氯水需存放在带玻璃塞的棕色试剂瓶中 B、可用广泛pH试纸测定新制氯水的pH值 C、NaClO与CO2反应的离子方程式为NaClO+CO2+H2O=HClO+Na++HCO D、使用NaClO消毒时,可用盐酸酸化6. NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。实验室用如图所示方法制备ClO2水溶液,下列说法错误的是( ) A、KClO3发生氧化反应 B、反应过程中需持续通入N2 C、乙装置应置于冰水浴中 D、丙装置用于吸收ClO2尾气7. NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。下列有关含氯微粒的说法正确的是( )A、ClO2是非极性分子 B、ClO的空间构型为平面三角形 C、ClO中心原子采取sp2杂化 D、1molHClO含有2molσ键8. 氨催化氧化是工业制硝酸的重要反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0。在T℃时,向1L密闭容器中投入4molNH3、5molO2 , 平衡时测得NH3的转化率为60%。在指定条件下,下列选项所示的物质间转化不能实现的是( )A、NH3·H2O(aq)NH4HSO4 B、HNO3(浓)NO2 C、NH4ClNH3 D、NON29. 氨催化氧化是工业制硝酸的重要反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0。在T℃时,向1L密闭容器中投入4molNH3、5molO2 , 平衡时测得NH3的转化率为60%。下列有关氨催化氧化反应的说法正确的是( )A、反应过程中分离出H2O(g),正反应速率增大 B、反应达到平衡时,相同时间内消耗NH3和NO的物质的量相等 C、平衡时向容器中继续通入O2 , 平衡正向移动,平衡常数增大 D、其他条件不变,起始时投入2molNH3、2.5molO2 , 平衡时NH3的转化率小于60%10. 弱碱性条件下,利用含砷氧化铜矿(含CuO、As2O3及少量不溶性杂质)制备Cu2(OH)2SO4的工艺流程如图。
A、KClO3发生氧化反应 B、反应过程中需持续通入N2 C、乙装置应置于冰水浴中 D、丙装置用于吸收ClO2尾气7. NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。下列有关含氯微粒的说法正确的是( )A、ClO2是非极性分子 B、ClO的空间构型为平面三角形 C、ClO中心原子采取sp2杂化 D、1molHClO含有2molσ键8. 氨催化氧化是工业制硝酸的重要反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0。在T℃时,向1L密闭容器中投入4molNH3、5molO2 , 平衡时测得NH3的转化率为60%。在指定条件下,下列选项所示的物质间转化不能实现的是( )A、NH3·H2O(aq)NH4HSO4 B、HNO3(浓)NO2 C、NH4ClNH3 D、NON29. 氨催化氧化是工业制硝酸的重要反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0。在T℃时,向1L密闭容器中投入4molNH3、5molO2 , 平衡时测得NH3的转化率为60%。下列有关氨催化氧化反应的说法正确的是( )A、反应过程中分离出H2O(g),正反应速率增大 B、反应达到平衡时,相同时间内消耗NH3和NO的物质的量相等 C、平衡时向容器中继续通入O2 , 平衡正向移动,平衡常数增大 D、其他条件不变,起始时投入2molNH3、2.5molO2 , 平衡时NH3的转化率小于60%10. 弱碱性条件下,利用含砷氧化铜矿(含CuO、As2O3及少量不溶性杂质)制备Cu2(OH)2SO4的工艺流程如图。
下列说法错误的是( )
A、“氨浸”时As2O3发生的离子反应为As2O3+6NH3+3H2O=6NH+2AsO B、“氨浸”后的滤液中存在的阳离子主要有:Cu2+、NH C、“氧化除AsO时生成1molFeAsO4 , 消耗(NH4)2S2O8为1.5mol D、“蒸氨”后的滤液中含有(NH4)2SO411. 非水性嵌入铝电池是一种二次电池,该电池放电过程的示意图如图所示(R+表示某有机阳离子)。充电时阳极的电极反应为Cn+AlCl-e-=CnAlCl4。下列说法正确的是( ) A、放电时,电极a的电极反应为Al+-3e-+3Cl-= B、放电时,电解质中AlCl的物质的量基本不变 C、充电时,电极b应与外接电源负极相连 D、充电时,电极a和电极b的质量均增加12. 化合物Z具有抗凝血作用,可由下列反应制得。下列有关说法正确的是( )
A、放电时,电极a的电极反应为Al+-3e-+3Cl-= B、放电时,电解质中AlCl的物质的量基本不变 C、充电时,电极b应与外接电源负极相连 D、充电时,电极a和电极b的质量均增加12. 化合物Z具有抗凝血作用,可由下列反应制得。下列有关说法正确的是( ) A、X分子中含有手性碳原子 B、Y分子存在顺反异构体 C、Z分子中所有碳原子均处于同一平面上 D、该反应是取代反应13. 已知室温下Ka1(H2S)=10-7 , Ka2(H2S)=10-12.9。通过下列实验探究含硫化合物的性质。
A、X分子中含有手性碳原子 B、Y分子存在顺反异构体 C、Z分子中所有碳原子均处于同一平面上 D、该反应是取代反应13. 已知室温下Ka1(H2S)=10-7 , Ka2(H2S)=10-12.9。通过下列实验探究含硫化合物的性质。实验l:测得0.1mol·L-1H2S溶液pH=4.1
实验2:向10mL0.1mol·L-1NaHS溶液中加入5mL水,测得溶液的pH不断减小
实验3:向实验2所得溶液中滴加10mL0.1mol·L-1NaOH溶液,测得反应后溶液pH=12
实验4:向实验3所得溶液中滴加几滴0.1mol·L-1MnSO4溶液,产生粉色沉淀,再加几滴0.1mol·L-1CuSO4溶液,产生黑色沉淀
下列说法正确的是( )
A、由实验1可知:0.1mol·L-1H2S溶液中c(S2-)<c(OH-) B、由实验2可知:加水过程中,逐渐变小 C、实验3所得溶液中存在:c(H2S)+c(HS-)+c(H+)=c(OH-) D、由实验4可知:Ksp(MnS)>Ksp(CuS)14. CO2催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程发生下列反应:反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58.6kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=41.2kJ·mol-1
0.5MPa下,将n(H2):n(CO2)=3的混合气体以一定流速通过装有催化剂的反应器,测得CO2的转化率、CH3OH或CO的选择性[×100%]以及CH3OH的收率(CO2的转化率×CH3OH的选择性)随温度的变化如图所示。下列说法正确的是( )
 A、CO(g)+2H2(g)=CH3OH(g) △H=99.8kJ·mol-1 B、曲线a表示CH3OH的选择性随温度的变化 C、图中所示270℃时,对应CO2的转化率为21% D、在210℃~250℃之间,CH3OH的收率增大是由于CH3OH的选择性增大导致
A、CO(g)+2H2(g)=CH3OH(g) △H=99.8kJ·mol-1 B、曲线a表示CH3OH的选择性随温度的变化 C、图中所示270℃时,对应CO2的转化率为21% D、在210℃~250℃之间,CH3OH的收率增大是由于CH3OH的选择性增大导致二、综合题
-
15. 含铬化合物在生产生活中有着广泛的用途。利用含铬废液(主要含Cr3+、Cl-、K+、SO等)可制备强氧化剂K2Cr2O7。.

已知:pH>6.5时Cr(VI)主要以CrO形式存在,pH<6.5时Cr(VI)主要以Cr2O形式存在。
(1)、含铬废液中存在[Cr(H2O)4Cl2]+ , 该微粒的中心离子基态核外电子排布式为。(2)、写出调节pH约为12时Cr3+被氧化为Cr(VI)的离子方程式:。(3)、加稀硫酸至溶液pH约为1。若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是。(4)、利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol·L-1K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。.①理论上需要向反应釜中加入蔗糖的物质的量为。
②测得一定温度下,反应釜内的压强和K2Cr2O7转化率与反应时间的关系如图所示,28~35min,压强减小的原因是。
 (5)、利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.10000mol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数(写出计算过程)。16. BiOCl是一种不溶于水和稀硫酸的环保涂料。一种以高铋银锌渣(主要成分为Bi单质,还含有Zn、Ag、Fe单质)制备BiOCl的工艺流程如图。
(5)、利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.10000mol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数(写出计算过程)。16. BiOCl是一种不溶于水和稀硫酸的环保涂料。一种以高铋银锌渣(主要成分为Bi单质,还含有Zn、Ag、Fe单质)制备BiOCl的工艺流程如图。
已知:BiCl+H2OBiOCl↓+2H++3Cl-
2BiOCl(白色)+2OH-2Cl-+H2O+Bi2O3(黄色)
(1)、“氧化浸出”生成BiCl的实验装置如图所示。
①写出生成BiCl的离子方程式:。
②工业在“氧化浸出”时常加入适量NaCl(s),其目的是。
③反应一段时间后,Bi完全浸出。将滤渣加入足量稀硝酸中,充分反应后,观察到滤渣部分溶解。该滤渣的成分为。
(2)、加入稀氨水调节溶液pH不宜过大的原因是。(3)、请补充完整利用含少量Fe(OH)3杂质的BiOCl粗品制备Bi2O3的实验方案: , 过滤、洗涤、干燥,得Bi2O3。(须使用的试剂有:1mol·L-1H2SO4溶液、4mol·L-1NaOH溶液、1mol·L-1BaCl2溶液、蒸馏水)17. 化合物G是制备乌帕替尼的关键中间体,一种合成化合物G的路线如图: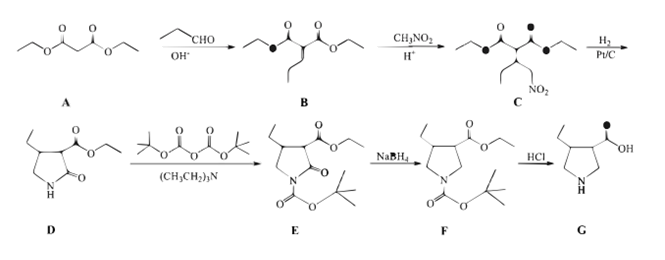 (1)、下列关于物质A的说法正确的是____。A、分子式为C7H14O4 B、名称为丙二酸二乙酯 C、熔点高于乙酸乙酯 D、一氯代物有两种(2)、E→F的反应类型为。(3)、B→C转化过程中还生成C的一种同分异构体M,M的结构简式为。(4)、请写出同时符合下列条件的B的一种同分异构体的结构简式:。
(1)、下列关于物质A的说法正确的是____。A、分子式为C7H14O4 B、名称为丙二酸二乙酯 C、熔点高于乙酸乙酯 D、一氯代物有两种(2)、E→F的反应类型为。(3)、B→C转化过程中还生成C的一种同分异构体M,M的结构简式为。(4)、请写出同时符合下列条件的B的一种同分异构体的结构简式:。①能与碳酸氢钠溶液反应产生气体。
②分子中含有碳碳π键,有3种化学环境不同的氢原子。
(5)、设计以CH3CH2OH、CH3COOH、CH3NO2为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 18. 甲醇催化、硼氢化钠水解、光催化分解水等方法是当前制氢领域研究的热点课题。(1)、甲醇催化制氢主要涉及以下两个反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g);CH3OH(g) CO(g)+2H2(g)。保持反应温度恒定,将H2O(g)与CH3OH(g)的混合气体按一定流速通过催化反应装置(单位时间内通过装置的混合气体总体积恒定),测得CH3OH转化率和CO选择性随水醇比[n(H2O):n(CH3OH)]变化的曲线如图1所示。实际制氢生产中选择水醇比为1.2而不选择1.9的原因是。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 18. 甲醇催化、硼氢化钠水解、光催化分解水等方法是当前制氢领域研究的热点课题。(1)、甲醇催化制氢主要涉及以下两个反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g);CH3OH(g) CO(g)+2H2(g)。保持反应温度恒定,将H2O(g)与CH3OH(g)的混合气体按一定流速通过催化反应装置(单位时间内通过装置的混合气体总体积恒定),测得CH3OH转化率和CO选择性随水醇比[n(H2O):n(CH3OH)]变化的曲线如图1所示。实际制氢生产中选择水醇比为1.2而不选择1.9的原因是。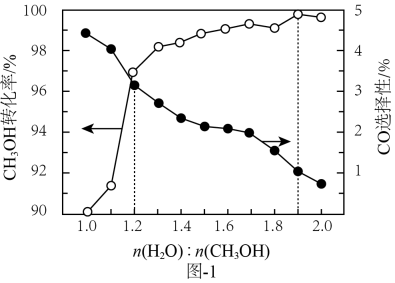 (2)、以Ru/C作催化剂,硼氢化钠(NaBH4)与水反应生成NaB(OH)4·2H2O细小晶体和H2。
(2)、以Ru/C作催化剂,硼氢化钠(NaBH4)与水反应生成NaB(OH)4·2H2O细小晶体和H2。①写出硼氢化钠与水反应的化学方程式:。
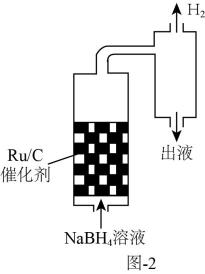
②已知粘度越大的液体,阻止微晶下沉的效果越好。相同温度下,将不同浓度的NaBH4溶液以相同的流速通过装有Ru/C催化剂的反应器(装置见图2)。质量分数为10%的NaBH4溶液通过反应器后,测得出液口溶液粘度为4.68mPa·s;质量分数为15%的NaBH4溶液通过反应器后,测得出液口溶液粘度为10.42mPa·s。不同质量分数的溶液反应50小时后,Ru/C催化剂的活性在15%的NaBH4溶液中大于10%的NaBH4溶液的原因是。
 (3)、基于TiO2材料光催化分解水制氢的可能机理如图3所示。
(3)、基于TiO2材料光催化分解水制氢的可能机理如图3所示。
①若使用H218O代替H2O分解制氢,则获得的氧气可能是(填字母)。
a.O2 b.18O2 c.Ol8O
②补充完成TiO2材料光催化分解水制氢的过程描述:在紫外光的照射下,TiO2材料的VB端将电子转移至CB端,。