湖北省鄂州市2020-2021学年高一下学期期末质量监测化学试题
试卷更新日期:2022-06-22 类型:期末考试
一、单选题
-
1. 下列物质属于烃类的是( )A、C60 B、C2H6O C、C3H8 D、C2H5NO22. 水与下列物质反应时,水表现出氧化性的是( )A、Na B、Cl2 C、NO2 D、SO23. 下列化学式既能表示物质的组成,又能表示物质的一个分子的是( )A、NaOH B、SiO2 C、Fe D、C4H104. 以下化学用语正确的是( )A、乙烯的结构简式:CH2CH2 B、CH4的比例模型:
 C、乙酸的分子式:C2H4O2
D、氯化钠的电子式:
C、乙酸的分子式:C2H4O2
D、氯化钠的电子式: 5. 下列物质不能使溴水褪色的是( )A、乙烯 B、二氧化硫 C、丁烯 D、丙烷6. 化学与人类生活密切相关。关于下列物质的使用不合理的是( )A、二氧化硫常用于食品增白 B、碳酸氢钠常用于焙制糕点 C、醋酸常用于除去水壶内的水垢 D、氢氧化铝常用于治疗胃酸过多7. 下表中陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是( )
5. 下列物质不能使溴水褪色的是( )A、乙烯 B、二氧化硫 C、丁烯 D、丙烷6. 化学与人类生活密切相关。关于下列物质的使用不合理的是( )A、二氧化硫常用于食品增白 B、碳酸氢钠常用于焙制糕点 C、醋酸常用于除去水壶内的水垢 D、氢氧化铝常用于治疗胃酸过多7. 下表中陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
Na2O2可以和CO2反应产生O2
Na2O2可用于工业制氧气
B
SO2具有抗氧化性且能杀菌消毒
葡萄酒中添加适量的SO2
C
SiO2具有良好的半导体性能
SiO2可用于制备光导纤维
D
NH3能使酚酞溶液变红
NH3可用于设计喷泉实验
A、A B、B C、C D、D8. 下列对实验过程的评价正确的是( )A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣ B、某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42﹣ C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ D、验证烧碱溶液中是否含Cl- , 先加稀盐酸除去OH﹣ , 再加硝酸银溶液,出现白色沉淀证明含Cl﹣9. 为了除去粗盐中的 、 , 及少量泥沙,得到纯净的 ,可将粗盐溶于水,下列操作顺序正确的是( )①过滤 ②加入过量的 溶液 ③加入过量的盐酸 ④加入过量的 溶液 ⑤加入过量的 溶液 ⑥加热蒸发
A、④①⑤②①③⑥ B、⑤①④②③⑥ C、②④⑤①③⑥ D、①②⑤④①③⑥10. 下列有机反应属于加成反应的是( )A、 B、 C、 D、 +3H2
+3H2 11. 如图是Zn和Cu形成的原电池,则下列结论中正确的是( )
11. 如图是Zn和Cu形成的原电池,则下列结论中正确的是( )①铜为负极,锌为正极;②铜极上有气泡;③SO42-向铜极移动;④锌发生还原反应;⑤电子的流向是铜到锌;⑥负极反应式:Zn-2e-=Zn2+
 A、①② B、①④⑥ C、②④⑥ D、②⑥12. 实验室制取、收集NH3 , 并组装NH3的喷泉实验装置。下列图示装置和原理能达到实验目的的是( )A、制NH3
A、①② B、①④⑥ C、②④⑥ D、②⑥12. 实验室制取、收集NH3 , 并组装NH3的喷泉实验装置。下列图示装置和原理能达到实验目的的是( )A、制NH3 B、干燥NH3
B、干燥NH3 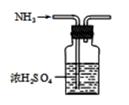 C、收集NH3
C、收集NH3  D、喷泉实验装置
D、喷泉实验装置  13. 下列化学反应不符合绿色化学理念的是( )A、除去硫酸厂尾气中的: B、除去硝酸工业尾气中的氮氧化物: C、制备: D、制备: ,14. 将盛有22mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积和剩余的2mL气体可能分别是( )A、1.2mL,NO B、2.4mL,O2 C、3.2mL,NO D、4mL,O215. 甲磺酸是一种可生物降解的强酸,在制药和电镀行业应用广泛。近日,德国GRILLO-WERKEAG化学公司的研究人员开发出一种将甲烷(CH4 , 天然气的主要成分)转化为甲磺酸(
13. 下列化学反应不符合绿色化学理念的是( )A、除去硫酸厂尾气中的: B、除去硝酸工业尾气中的氮氧化物: C、制备: D、制备: ,14. 将盛有22mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积和剩余的2mL气体可能分别是( )A、1.2mL,NO B、2.4mL,O2 C、3.2mL,NO D、4mL,O215. 甲磺酸是一种可生物降解的强酸,在制药和电镀行业应用广泛。近日,德国GRILLO-WERKEAG化学公司的研究人员开发出一种将甲烷(CH4 , 天然气的主要成分)转化为甲磺酸( )的方法,其产率和选择性接近100%(SClence2019),下列关于CH4的说法中错误的是( ) A、天然气属于混合物 B、1molCH4中含有的电子数为16NA C、标准状况下,32gCH4的体积约为44.8L D、CH4完全燃烧生成CO2 , 若生成0.5molCO2 , 转移的电子数为4NA
)的方法,其产率和选择性接近100%(SClence2019),下列关于CH4的说法中错误的是( ) A、天然气属于混合物 B、1molCH4中含有的电子数为16NA C、标准状况下,32gCH4的体积约为44.8L D、CH4完全燃烧生成CO2 , 若生成0.5molCO2 , 转移的电子数为4NA二、综合题
-
16. 已知:A是来自石油的重要有机化工原料,A的产量可以用来衡量一个国家石油化工发展水平,D是日常生活中常用的调味品的主要成分,E是具有果香味的有机物。
 (1)、A分子中官能团名称是;A的电子式为。(2)、D的结构简式是;F的名称是。(3)、①的有机化学反应类型为;③的有机化学反应类型为。(4)、当甲烷中混有A时,(填“能”或“不能”)用酸性高锰酸钾溶液除去。(5)、写出反应②的化学方程式:。17. 依据图中硫元素及其化合物的转化关系,回答问题:
(1)、A分子中官能团名称是;A的电子式为。(2)、D的结构简式是;F的名称是。(3)、①的有机化学反应类型为;③的有机化学反应类型为。(4)、当甲烷中混有A时,(填“能”或“不能”)用酸性高锰酸钾溶液除去。(5)、写出反应②的化学方程式:。17. 依据图中硫元素及其化合物的转化关系,回答问题: (1)、图中,请写出反应①的离子方程式。(2)、图中,X的化学式为 , 从化合价上看,X具有(填数字)
(1)、图中,请写出反应①的离子方程式。(2)、图中,X的化学式为 , 从化合价上看,X具有(填数字)①氧化性;②还原性
(3)、图中,W在医疗上可用作石膏绷带,关于它的用途还有(填数字)。①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)、反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为mol。也可表示为2H2S+SO2=3S↓+2H2O,当生成1molS时,转移的电子为mol。(5)、SO2可使酸性高锰酸钾溶液褪色,体现了(填数字)①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:。
18.(1)、I.联氨(N2H4)是火箭燃料,有专家设计了一种联氨环保电池,其工作原理如图所示。回答下列问题:
联氨的电子式为。
(2)、c口通入 , N极为电源的极,N极反应式。(3)、M极反应式为 , 电极附近碱性(填增强、减弱或不变)。(4)、Ⅱ.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是____。A、将肉类等食品进行低温冷藏,能使其永远不会腐败变质 B、在化学工业中,催化剂不参与反应,但能增大反应速率 C、自然条件下,夏天面粉发酵速度与冬天面粉发酵速度相差不大 D、茶叶等包装中加入的还原性铁粉能延长茶叶储存时间(5)、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是____。A、对该反应体系加热 B、向溶液中滴加浓硝酸,以增大氢离子浓度 C、滴加少量CuSO4溶液 D、改用铁粉 E、改用浓度为98.3%的浓硫酸(6)、反应4A(s)+3B(g)=2C(g)+D(g),经2min,B的浓度减少0.6mol·L-1。对此反应速率的表示正确的是____。A、用A表示的反应速率是0.4mol·(L·min)-1 B、分别用B、 C、D表示反应的速率,其比是3:2:1C.在2min末的反应速率,用B表示是0.3mol·(L·min)-1 D、在这2min内用B和C表示的反应速率的值都是逐渐减小的(7)、Ⅲ.化学反应伴随着能量变化是化学反应的基本特征之一下列物质发生的变化中属于吸热反应的是。
①氢氧化钡与氯化铵混合后搅拌 ②盐酸滴入碳酸氢钠
③炽热的碳与二氧化碳 ④硝酸铵固体投入水中
(8)、某同学进行如下实验,以检验化学反应中的能量变化。回答问题:实验中发现,反应后温度计示数升高。由此判断铝条与盐酸的反应是(填“吸”或“放”)热反应。其能量变化(填“能”或“不能”)用如图表示。

 19. 某研究小组以工厂废渣(Fe3O4、Al2O3、SiO2)为原料制取Fe2O3工艺流程如图。回答下列问题:
19. 某研究小组以工厂废渣(Fe3O4、Al2O3、SiO2)为原料制取Fe2O3工艺流程如图。回答下列问题: (1)、“碱浸”时可能发生的反应有个。“酸溶”时发生反应的化学方程式为。(2)、“操作a”的名称为 , 用到的玻璃仪器有玻璃棒、。(3)、“氧化”的目的是。(填能或否)用H2O2代替O2 , 检验氧化不完全可加入的试剂是。(4)、“沉铁”步骤可观察到现象是 , (填能或否)用氨水代替NaOH溶液。(5)、操作c中所发生的化学反应方程式为。
(1)、“碱浸”时可能发生的反应有个。“酸溶”时发生反应的化学方程式为。(2)、“操作a”的名称为 , 用到的玻璃仪器有玻璃棒、。(3)、“氧化”的目的是。(填能或否)用H2O2代替O2 , 检验氧化不完全可加入的试剂是。(4)、“沉铁”步骤可观察到现象是 , (填能或否)用氨水代替NaOH溶液。(5)、操作c中所发生的化学反应方程式为。