湖南省五市十校2020-2021学年下学期高一期末联考化学试题
试卷更新日期:2022-06-22 类型:期末考试
一、单选题
-
1. 化学与生产、生活、科技息息相关,下列说法正确的是( )A、利用微生物降解水域中的有毒有害物质涉及到化学反应 B、硅单质常被用于制造太阳能电地和制作光导纤维 C、常温下,铁不与浓硝酸反应,所以可用铁质容器储运冷的浓硝酸 D、“84”消毒液和75%酒精杀灭COVID-19时均表现为强氧化性2. 下列化学用语表示正确的是( )A、的结构示意图:
 B、乙烯的结构式:
C、乙醇的官能团:
D、的电离方程式:
3. 下列过程中没有颜色变化的是( )A、淀粉与碘水混合 B、一氧化氮与空气混合 C、新制氯水在光照下敞口久置 D、甲烷通入酸性溶液中4. 生命在于运动,而生命活动的维持离不开能量,糖类、油质、蛋白质是基本营养物质。下列说法错误的是( )A、淀粉、油脂、蛋白质都能发生水解反应 B、糖尿病人食用的“无糖饼干”主要成分为面粉,不含糖类物质 C、我国新冠疫苗安全有效,助力全球抗疫,疫苗运输需低温保存 D、液态植物油经过氢化后可用于生产人造奶油,该反应属于加成反应5. 下列各组物质中,互为同分异构体的是( )A、和 B、金刚石和石墨 C、和 D、
B、乙烯的结构式:
C、乙醇的官能团:
D、的电离方程式:
3. 下列过程中没有颜色变化的是( )A、淀粉与碘水混合 B、一氧化氮与空气混合 C、新制氯水在光照下敞口久置 D、甲烷通入酸性溶液中4. 生命在于运动,而生命活动的维持离不开能量,糖类、油质、蛋白质是基本营养物质。下列说法错误的是( )A、淀粉、油脂、蛋白质都能发生水解反应 B、糖尿病人食用的“无糖饼干”主要成分为面粉,不含糖类物质 C、我国新冠疫苗安全有效,助力全球抗疫,疫苗运输需低温保存 D、液态植物油经过氢化后可用于生产人造奶油,该反应属于加成反应5. 下列各组物质中,互为同分异构体的是( )A、和 B、金刚石和石墨 C、和 D、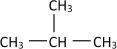 和
和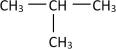 6. 下列关于化学反应与能量的说法中,正确的是( )A、化学反应中必然伴随有温度的升高 B、燃料电池工作时,化学能全部转化为电能 C、石墨转化为金刚石时需要吸收能量,说明石墨更稳定 D、根据能量守恒定律,放热反应中反应物的能量一定高于生成物的能量7. 一定温度下,在恒容器闭容器中发生反应: , 当CO、、的浓度不再变化时,下列说法正确的是( )A、该反应已经停止 B、容器内气体的压强保持不变 C、CO和全部转化为 D、CO、、的浓度之比为8. 绿色化学的“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材科尽可能多的转化到最终产物中,以下反应最符合绿色化学的“原子经济性”要求的是( )A、利用SO2与反应制备 B、甲烷与氯气反应制取四氯化碳 C、以铜和浓硝酸为原科制取硝酸铜 D、一定条件下,用乙烯与水反应制取乙醇9. 设为阿伏加德罗常数的值,下列叙述中正确的是( )A、中含有的质子数为7 B、标况下,22.4L苯中所含碳碳双键的数目为3 C、和充分反应后生成的分子数为0.2 D、由与组成的混合物中阴离子总数为0.210. W、X、Y、Z是原子序数依次增大的4种短周期主族元素。W的一种单质是自然界中最硬的物质。X的一种单质是光合作用的产物,Y、Z组成的化合物是食用盐的主要成分。下列说法正确的是( )A、简单离子半径大小: B、X、W的最简单气态氢化物的沸点: C、氧化物对应水化物的酸性: D、电解YZ的饱和水溶液,可得到Y的单质11. 实验室常用二氧化锰与浓盐酸共热制取氯气,对于该反应,下列说法正确的是( )A、二氧化锰是该反应的催化剂 B、该反应涉及的氧化物有两种 C、可用浓硫酸除去氯气中的氯化氢气体杂质 D、反应中,还原剂与氧化产物的物质的量之比为12. 某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果正确的是( )
6. 下列关于化学反应与能量的说法中,正确的是( )A、化学反应中必然伴随有温度的升高 B、燃料电池工作时,化学能全部转化为电能 C、石墨转化为金刚石时需要吸收能量,说明石墨更稳定 D、根据能量守恒定律,放热反应中反应物的能量一定高于生成物的能量7. 一定温度下,在恒容器闭容器中发生反应: , 当CO、、的浓度不再变化时,下列说法正确的是( )A、该反应已经停止 B、容器内气体的压强保持不变 C、CO和全部转化为 D、CO、、的浓度之比为8. 绿色化学的“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材科尽可能多的转化到最终产物中,以下反应最符合绿色化学的“原子经济性”要求的是( )A、利用SO2与反应制备 B、甲烷与氯气反应制取四氯化碳 C、以铜和浓硝酸为原科制取硝酸铜 D、一定条件下,用乙烯与水反应制取乙醇9. 设为阿伏加德罗常数的值,下列叙述中正确的是( )A、中含有的质子数为7 B、标况下,22.4L苯中所含碳碳双键的数目为3 C、和充分反应后生成的分子数为0.2 D、由与组成的混合物中阴离子总数为0.210. W、X、Y、Z是原子序数依次增大的4种短周期主族元素。W的一种单质是自然界中最硬的物质。X的一种单质是光合作用的产物,Y、Z组成的化合物是食用盐的主要成分。下列说法正确的是( )A、简单离子半径大小: B、X、W的最简单气态氢化物的沸点: C、氧化物对应水化物的酸性: D、电解YZ的饱和水溶液,可得到Y的单质11. 实验室常用二氧化锰与浓盐酸共热制取氯气,对于该反应,下列说法正确的是( )A、二氧化锰是该反应的催化剂 B、该反应涉及的氧化物有两种 C、可用浓硫酸除去氯气中的氯化氢气体杂质 D、反应中,还原剂与氧化产物的物质的量之比为12. 某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果正确的是( )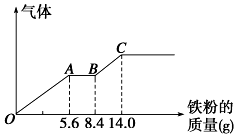 A、OA段和BC段生成的都是NO气体 B、AB段发生的反应为 C、C点之后的溶液中溶质只有 D、原混合溶液中的浓度为1.5mol/L
A、OA段和BC段生成的都是NO气体 B、AB段发生的反应为 C、C点之后的溶液中溶质只有 D、原混合溶液中的浓度为1.5mol/L二、多选题
-
13. 下列实验操作能达到目的的是( )
选项
操作
目的
A
除去中的杂质
向混合物中加入足量NaOH溶液,充分反应后过滤、洗涤、干燥
B
测定相同浓度的HCl溶液、HBr溶液的pH
比较Cl和Br的非金属性强弱
C
将相同大小的镁片和铝片用导线连接,插入NaOH溶液中
证明原电池中活泼性较强的金属作负极
D
向蔗糖溶液中加入新制的银氨溶液,水浴加热
证明蔗糖是非还原性糖
A、A B、B C、C D、D14. 海水提镁的主要流程如图所示。下列说法正确的是( )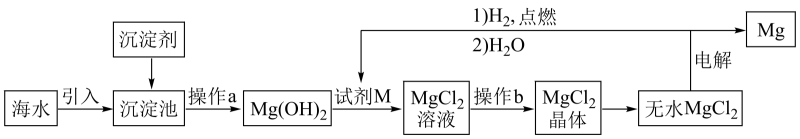 A、工业上常用CaO作沉淀剂 B、试剂M能导电,故其是电解质 C、根据流程图可知,试剂M可以循环利用 D、实验室在进行操作a时,用到的玻璃仪器只有2种
A、工业上常用CaO作沉淀剂 B、试剂M能导电,故其是电解质 C、根据流程图可知,试剂M可以循环利用 D、实验室在进行操作a时,用到的玻璃仪器只有2种三、综合题
-
15. 下图为元素周期表的一部分。根据元素①~⑦在周期表中的位置,按要求回答下列问题。
族
周期
ⅠA
0
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
②
③
④
⑤
⑥
⑦
(1)、元素①~⑦的单质中氧化性最强的是。(填化学式)(2)、元素③⑤⑥的原子的半径从大到小的顺序是。(用元素符号表示)(3)、元素②的简单气态氢化物的沸点高于元素⑥的,原因是。(4)、元素②④⑦按原子数组成化合物甲,甲中所含化学键的类型是。(5)、元素①与④组成的化合物可与水反应,写出反应的化学方程式。(6)、元素④⑥⑦的最高价氧化物对应的水化物分别为A、B、C.相同条件下。相同物质的量浓度的A、B、C的水溶液中最大的是。(填化学式)(7)、元素①与⑦组成的化合物为乙。用电子式表示乙的形成过程。16. 回答下列问题。(1)、结合钠与水的反应观象,从能量变化的角度看,钠与水的反应属于反应。(2)、以硫酸铜为电解质溶液的银锌原电池中。银片上观察到的现象是;锌电极的反应式为 , 溶液中向极移动。(3)、将一定量的A气体和B气体在2L的密闭容器中混合并在一定条件下发生反应; , 反应2min后测得C的浓度为0.6mol/L。①用物质B表示的平均反应速率为。
②其他条件不变时,再通入2molA气体,该反应的正反应速率将(填“增大”“不变”或“减小”)。
17. 石油经裂解可获得大量化工产品A,以A为原料合成香料D的流程如下:
请回答下列问题:
(1)、在标准状况下,烃A的密度约为g/L。(2)、物质B的官能团的名称为 , 常用于检验该官能团的一种悬浊液是。(3)、反应②的有机反应类型为。(4)、写出物质C与金属钠反应的化学方程式。(5)、与物质C按物质的量反应生成D.则D的化学式为。(6)、T是D的同分异构体。与足量的碳酸氢钠溶液反应能放出(标准状况下)。则T的可能结构有种。(不考虑立体异构)18. 工业上常用铁质容器盛装冷的浓硫酸。为研究铁质材料与浓硫酸的反应。某学习小组进行了以下探究活动:(1)、Ⅰ.将已去除表面氧化物的铁钉(碳索钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观实,铁钉表面无明显变化,其原因是。(2)、另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学认为X中除外还可能含有 , 若要检验其中是否含有 , 应选用(选填序号)。a.KSCN溶液 b.NaOH溶液 c.酸性溶液
(3)、乙同学取336mL(标况)气体Y通入足量溴水中,发生反应: , 然后加入足量溶液,得干燥固体2.33g。由此推知气体Y中的体积分数为%(保留小数点后1位)。(4)、Ⅱ.分析上述实验中体积分数的结果,丙同学认为气体Y中还可能含有和气体。为此设计了下列探究实验装置(部分装置已省略)。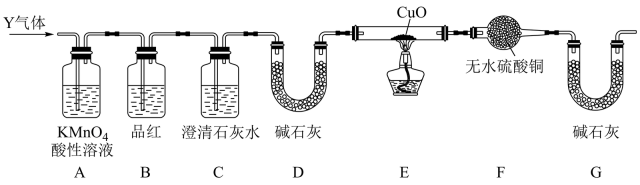
装置A中酸性溶液的作用是除去气体Y中的 , 反应的离子方程式为。
(5)、若能证明气体Y中含有 , 则对应的实验现象是。(6)、实验时,F中无水硫酸铜变蓝色,则E中反应的化学方程式为。此现象表明Y中含有 , 产生的原因是。