湖北省十堰市2020-2021学年高一下学期期末调研考试化学试题
试卷更新日期:2022-06-22 类型:期末考试
一、单选题
-
1. 2021年4月9日,我国在太原卫星发射中心用“长征四号”乙运载火箭,成功将试验六号03星发射升空,卫星顺利进入预定轨道。试验六号03星采用太阳能电池板提供能量,制造太阳能电池板的核心材料是( )A、二氧化硅 B、硅 C、钛合金 D、铝合金2. 国产科幻片《流浪地球》中有个画面,冰原上身穿“核电池全密封加热服”的人类,一旦被卸下核电池,人就被冻僵。该核电池装置提供电能,再将电能转化为( )A、热能 B、化学能 C、光能 D、动能3. 下列说法中正确的是( )A、糖类和蛋白质都是高分子 B、糖类、油脂和蛋白质都是由C,H,O三种元素组成的 C、油脂都不能使溴水褪色 D、淀粉和纤维素可用于生产乙醇4. 下列物质中酸性最弱的是( )A、HClO4 B、H2SiO3 C、H3PO4 D、HNO35. 大部分金属的冶炼都是通过高温下发生的氧化还原反应来进行的,常用的还原剂有焦炭、二氧化碳、氢气等,一些活泼金属也可以作还原剂,下列金属不能通过铝热反应原理制取的是( )A、钠 B、铁 C、铜 D、锌6. 下列分子式只能表示一种物质的是( )A、C4H10 B、C6H6 C、C3H8 D、C4H8O27. 下列有机反应属于加成反应的是( )A、 B、 C、 D、8. 下列各组中的两种物质发生反应:①铁与硫酸;②AlCl3与氨水;③NaOH与CO2;④SO2与O2。因反应物用量、浓度不同而能生成不同产物的是( )A、①② B、②④ C、①③ D、③④9. 科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的历程(如图所示)。下列说法错误的是( )
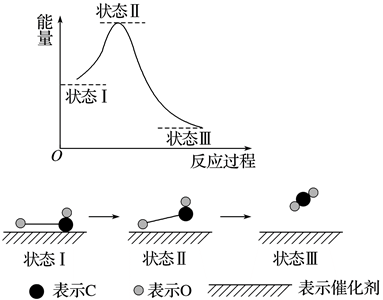 A、CO和O生成CO2的反应是放热过程 B、在该过程中,没有断裂非极性共价键 C、CO2中每个原子的最外层均达到了8电子稳定结构 D、状态Ⅰ→状态Ⅲ表示CO与O2反应的历程10. 短周期元素X、Y、Z、W在元素周期表中的位置如图所示。W的单质能溶于水,且与水反应后能生成具有漂白性的物质,下列说法中正确的是( )
A、CO和O生成CO2的反应是放热过程 B、在该过程中,没有断裂非极性共价键 C、CO2中每个原子的最外层均达到了8电子稳定结构 D、状态Ⅰ→状态Ⅲ表示CO与O2反应的历程10. 短周期元素X、Y、Z、W在元素周期表中的位置如图所示。W的单质能溶于水,且与水反应后能生成具有漂白性的物质,下列说法中正确的是( )X
Y
Z
W
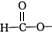
A、原子半径:W>Z B、这四种元素形成的单质中,Z的单质的熔、沸点最低 C、X、Y两种元素能形成多种化合物 D、最高价氧化物对应水化物的酸性:Z>W11. 硝酸铜是制备系催化剂的重要原料,常用的制取硝酸铜的方法有下列两种:①金属铜法:将浓硝酸加入反应器中,边搅拌边缓慢加入铜屑;②氧化铜法:将氧气通入铜屑与稀硝酸的反应体系中。下列说法错误的是( )A、金属铜法制取硝酸铜时,会产生 B、氧化铜法可以在铁制或铝制容器中进行 C、两种方法中硝酸的利用率:②>① D、氧化铜法的总反应为12. 设为阿伏加德罗常数的值,下列说法错误的是( )A、44g丙烷中含有的共价键总数为10 B、28g由乙烯和丙烯()组成的混合物完全燃烧生成的分子的数目为2 C、标准状况下,2.24L分子中含C-H键的数目为0.3 D、0.5mol/L的醋酸溶液中所含分子的数目一定小于13. 下列物质的类别与其所含官能团均正确的是( )选项
A
B
C
D
物质
CH3CH2CH2Br

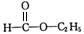
CH3CHO
类别
烃
酯
羧酸
醛
所含官能团
-Br
-COOH
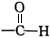 A、A B、B C、C D、D14. CH3OH和O2构成的质子交换膜燃料电池的结构如图所示,电池总反应为 。下列说法错误的是( )
A、A B、B C、C D、D14. CH3OH和O2构成的质子交换膜燃料电池的结构如图所示,电池总反应为 。下列说法错误的是( )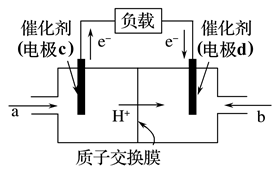 A、电极d是正极,发生还原反应 B、电极c的电极反应式为 C、当外电路中转移2mol电子时,消耗11.2L氧气 D、利用该装置将化学能转化为电能
A、电极d是正极,发生还原反应 B、电极c的电极反应式为 C、当外电路中转移2mol电子时,消耗11.2L氧气 D、利用该装置将化学能转化为电能二、多选题
-
15. 有机物M是一种抑制生长的植物激素,可以刺激乙烯的产生,催促果实成熟,其结构简式如图所示,下列关于有机物M的性质的描述正确的是( )
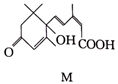 A、M既可以和乙醇发生酯化反应,也可以和乙酸发生酯化反应 B、1molM和足量的钠反应生成1molH2 C、1molM最多可以和2molBr2发生加成反应 D、1molM可以和NaHCO3发生反应,且可生成22.4LCO2
A、M既可以和乙醇发生酯化反应,也可以和乙酸发生酯化反应 B、1molM和足量的钠反应生成1molH2 C、1molM最多可以和2molBr2发生加成反应 D、1molM可以和NaHCO3发生反应,且可生成22.4LCO2三、综合题
-
16. 海水是一种重要的自然资源,利用海水可得到一系列产品。根据下列流程回答问题:
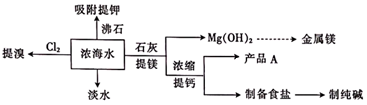
熔点:MgO 2800℃;MgCl2 712℃。
(1)、从海水中获得淡水的主要方法有电渗析法、蒸馏法和(填一种方法)。(2)、工业上常用的一种“提溴”技术叫做“吹出法”,其过程主要包括氧化、吹出、吸收、蒸馏等环节,“氧化”工序中发生的主要反应是(用离子方程式表示)。(3)、“产品A”的主要成分是(填化学式)。(4)、“提镁”工序获取氢氧化镁操作的名称是;由氢氧化镁进一步加工获得的MgCl2可用于电解法获取镁单质。冶炼镁时,电解熔融MgCl2而不电解熔融MgO的原因是。将铝和镁作电极插入氢氧化钠溶液中,作负极的是(填化学式);写出正极的电极反应式:。(5)、侯德榜是我国近代化学工业的奠基人,在经过数百次的试验后,侯德榜终于确定了制备纯碱的新工艺。该新工艺制备纯碱的方法为将二氧化碳和氨气通入饱和食盐水中获得碳酸氢钠和氯化铵,为了提高产率,应往饱和食盐水中先通入(填化学式,下同),后通入 , 写出该方法中获得碳酸氢钠和氯化铵的化学方程式:。17. 化学反应速率与限度在生产生活中的运用广泛。(1)、某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应生成的氢气(标准状况),实验记录如下表(累计值):时间/min
1
2
3
4
5
氢气体积/mL
50
120
232
290
310
在0~1 min、1~2 min、2~3min、3~4 min、4~5 min时间段中,反应速率最大的时间段是 , 原因为。
(2)、反应在一容积可变的密闭容器中进行,达到平衡后,增加Fe的量,其正反应速率(填“增大”、“不变”或“减小”,下同),保持体积不变,充入Ar使体系压强增大,其逆反应速率。(3)、一定温度下,将3 mol气体A和1 mol气体B通入一体积为2 L的恒容密闭容器中,发生反应:。1 min时,测得剩余1.8 mol A,C的浓度为0.4 mol/L。①x=。
②反应经2 min达到平衡,平衡时C的浓度(填“大于”、“小于”或“等于”)1 mol/L。
③达到平衡时,容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达到平衡时反应物A的转化率:。
18. 实验小组为探究氨气与二氧化氮的反应,设计如下实验装置,请回答相关问题: (1)、A装置中生成氨气的原因是 , 写出用熟石灰与氯化铵固体共热制得氨气的反应方程式:。(2)、B和D装置的作用都是干燥气体,其中盛装的干燥剂选择合理的是(填标号)。
(1)、A装置中生成氨气的原因是 , 写出用熟石灰与氯化铵固体共热制得氨气的反应方程式:。(2)、B和D装置的作用都是干燥气体,其中盛装的干燥剂选择合理的是(填标号)。a.甲、乙都是碱石灰
b.甲、乙都是无水氯化钙
c.甲是碱石灰,乙是五氧化二磷
d.甲是五氧化二磷,乙是碱石灰
(3)、若氨气与二氧化氮反应生成的产物为水和氮气,则该反应的化学方程式为。(4)、该实验设计中存在着一个很严重的缺陷是。(5)、E装置用于制备二氧化氮气体,写出该反应的化学方程式:。取12.8 g铜于E装置的锥形瓶中,再加入50 mL一定浓度的浓硝酸,充分反应后铜全部溶解,收集到NO2和NO的混合气体4.48 L(已折算成标准状况),则它们的物质的量之比n(NO):n(NO2)为。19. 工业上一种利用石油化工产品合成F的路线如图所示。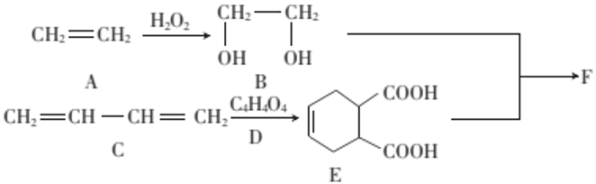
已知:①
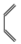 +
+ 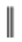
 ;
;②F中含有两个环,分子式为。
(1)、E中含有的官能团的名称为。(2)、在铜的催化作用下,B可被氧气氧化成乙二醛(OHCCHO),该反应的化学方程式为 , 其中醛基的电子式为。(3)、D的结构简式为 , 的反应类型为。(4)、写出B与E反应生成F的化学方程式: , 该反应的反应类型为。
-