河南省信阳市2020-2021学年高一下学期期末教学质量检测化学试题
试卷更新日期:2022-06-22 类型:期末考试
一、单选题
-
1. 下列生活中的化学说法错误的是( )A、人们常在元素周期表的右上区域寻找制备农药的元素 B、调味剂、除氧剂、着色剂等食品添加剂中,除氧剂使用目的与反应速率有关 C、暖宝宝热贴的发热原理主要是铁粉在空气中被还原而发生放热反应 D、某论文声称“熟鸡蛋返生孵小鸡”,其违背了加热使蛋白质变性不可逆的原理2. 近日,美国遭遇史上最严重的氯短缺,氯消毒片价格暴涨,下列有关氯的说法正确的是( )A、得电子能力强于 B、在分子中,质量数与中子数之差为18 C、和制漂白粉反应中有极性键、非极性键、离子键的破坏和生成 D、与氯气反应、与氯气反应的反应类型一定不同3. 设为阿伏加德罗常数的值,下列叙述正确的是( )A、0.5mol己烯和苯混合液体中氢原子数为4.5 B、2mol与7mol充分反应生成的分子数为4 C、甲烷燃料电池的外电路转移8个电子,消耗标况下的甲烷气体11.2L D、都含个硫原子的固态硫、气态硫分别与过量氧气完全反应,后者放出能量多4. 下列说法正确的是( )A、与互为同位素,在周期表中位置相同 B、与是同素异形体,阴阳离子个数之比均为 C、与一定是同系物,其化学性质相似 D、金刚石和石墨是同分异构体,都可以导电5. 往盛有少量醋酸的大烧杯中放入盛有粉末的小烧杯,然后向小烧杯中加入盐酸,观察到大烧杯中醋酸逐渐凝固。下列推断错误的是( )
 A、与盐酸反应中,反应物总能量小于生成物总能量 B、与盐酸的反应不可能设计成原电池 C、适当加大盐酸浓度,可以使醋酸凝固的更快 D、醋酸凝固是一个放热反应6. 如图是四种常见有机物的模型示意图。下列说法正确的是( )
A、与盐酸反应中,反应物总能量小于生成物总能量 B、与盐酸的反应不可能设计成原电池 C、适当加大盐酸浓度,可以使醋酸凝固的更快 D、醋酸凝固是一个放热反应6. 如图是四种常见有机物的模型示意图。下列说法正确的是( ) A、甲与氯气在光照条件下反应,得到的有机产物最多有9种 B、乙可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色,二者褪色原理相似 C、将铜片在酒精灯上加热后插入丙溶液,铜片质量增加 D、往丁中不断加水,pH会一直增大7. 某有机物的键线式如图,下列有关该有机物的说法正确的是( )
A、甲与氯气在光照条件下反应,得到的有机产物最多有9种 B、乙可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色,二者褪色原理相似 C、将铜片在酒精灯上加热后插入丙溶液,铜片质量增加 D、往丁中不断加水,pH会一直增大7. 某有机物的键线式如图,下列有关该有机物的说法正确的是( ) A、该有机物分子式为 B、该有机物与钠完全反应时,二者物质的量之比为 C、1mol该有机物可以与2mol氢气发生加成反应 D、该有机物中所有碳原子可以共面8. 下列选用的装置和操作能达到实验目的的是( )
A、该有机物分子式为 B、该有机物与钠完全反应时,二者物质的量之比为 C、1mol该有机物可以与2mol氢气发生加成反应 D、该有机物中所有碳原子可以共面8. 下列选用的装置和操作能达到实验目的的是( )A
B
C
D




分离乙酸乙酯与饱和碳酸溶液
铝热反应
甲烷与氯气的反应
制取乙酸乙酯
A、A B、B C、C D、D9. 有五种主族元素位于元素周期表前四周期,其位置关系如图所示,乙是一种亲氧元素,在自然界中无单质形式存在,以化合物形态存在于岩石和土壤中,下列说法正确的是( )丁
甲
乙
丙
戊
A、五种元素中最高价氧化物对应的水化物酸性,丁最强 B、乙的氧化物既与NaOH反应,也与HF反应,其为两性氧化物 C、丙元素位于周期表第15列 D、丁的氢化物沸点低于丙的氢化物10. 已知常温下,浓盐酸与高锰酸钾反应可以生成氯气。如图甲、乙、丙三处分别是沾有NaBr溶液的棉花、润湿的淀粉-KI试纸、润湿的品红试纸,下列说法正确的是( )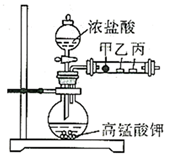 A、该实验通过现象可以证明氧化性: B、沾有品红溶液的试纸会褪色,若再对丙微热则恢复红色 C、甲的现象也可以证明的还原性强于 D、与NaBr溶液反应的实质与与NaBr溶液反应类似11. 化学反应中有各种类别的反应式来表示不同的含义,下列情景下的反应式书写正确的是( )A、往溶液中滴加过量溶液,发生反应的离子方程式: B、用电子式表示氯化镁的形成过程:
A、该实验通过现象可以证明氧化性: B、沾有品红溶液的试纸会褪色,若再对丙微热则恢复红色 C、甲的现象也可以证明的还原性强于 D、与NaBr溶液反应的实质与与NaBr溶液反应类似11. 化学反应中有各种类别的反应式来表示不同的含义,下列情景下的反应式书写正确的是( )A、往溶液中滴加过量溶液,发生反应的离子方程式: B、用电子式表示氯化镁的形成过程: C、碱性电解液环境下的甲烷燃料电池负极电极反应式:
D、等物质的量和同时通入水中,发生反应的离子方程式:
12. 某微生物电池可处理硝酸盐废水达到无毒排放,其工作原理示意图如图所示,已知a室中微生物降解有机物产生、和 , 下列说法错误的是( )
C、碱性电解液环境下的甲烷燃料电池负极电极反应式:
D、等物质的量和同时通入水中,发生反应的离子方程式:
12. 某微生物电池可处理硝酸盐废水达到无毒排放,其工作原理示意图如图所示,已知a室中微生物降解有机物产生、和 , 下列说法错误的是( ) A、通过质子交换膜从a室进入b室 B、a室内发生氧化反应,是电流流出的一极 C、b室内电极反应式: D、若改成微生物燃料电池,氧气可以代替图中的硝酸盐13. 下列各组物质的鉴别所用试剂错误的是( )A、鉴别碳酸钠、碳酸氢钠可用氢氧化钙溶液 B、鉴别乙醇、乙酸、乙酸乙酯可用碳酸钠溶液 C、鉴别二氧化氮、溴蒸气可用蒸馏水 D、鉴别植物油、苯、乙酸可用溴水14. 某实验小组研究一定温度下的反应: , 根据表格中实验数据绘制的浓度-时间曲线如图所示,下列说法错误的是( )
A、通过质子交换膜从a室进入b室 B、a室内发生氧化反应,是电流流出的一极 C、b室内电极反应式: D、若改成微生物燃料电池,氧气可以代替图中的硝酸盐13. 下列各组物质的鉴别所用试剂错误的是( )A、鉴别碳酸钠、碳酸氢钠可用氢氧化钙溶液 B、鉴别乙醇、乙酸、乙酸乙酯可用碳酸钠溶液 C、鉴别二氧化氮、溴蒸气可用蒸馏水 D、鉴别植物油、苯、乙酸可用溴水14. 某实验小组研究一定温度下的反应: , 根据表格中实验数据绘制的浓度-时间曲线如图所示,下列说法错误的是( )t/min
0
1
2
3
c(M)/mol/L
0.16
0.10
0.04
0.02
c(N)/mol/L
0
0.03
0.06
0.07
 A、曲线b是M的浓度变化曲线 B、在3min内,随着N浓度越大,正反应速率减小,逆反应速率增大 C、1~3min内, D、时, , 反应达到平衡状态15. 某化学反应的能量变化如图所示,则下列说法中正确的是( )
A、曲线b是M的浓度变化曲线 B、在3min内,随着N浓度越大,正反应速率减小,逆反应速率增大 C、1~3min内, D、时, , 反应达到平衡状态15. 某化学反应的能量变化如图所示,则下列说法中正确的是( ) A、该反应为放热反应,无需加热就可以发生 B、断裂1mol键和1mol键要吸收xkJ的能量 C、根据图示可知生成1molAB (g)放出的能量 D、三种物质(g)、(g)、AB(g)中,最稳定的物质一定是AB(g)16. 某科研团队成功利用阴离子合成某全氮类物质 , 下列说法正确的是( )A、1mol中含有电子数为70NA B、是离子化合物 C、中既含极性共价键也含非极性共价键 D、新合成的一种离子化合物中,其含有的五氮离子应该是
A、该反应为放热反应,无需加热就可以发生 B、断裂1mol键和1mol键要吸收xkJ的能量 C、根据图示可知生成1molAB (g)放出的能量 D、三种物质(g)、(g)、AB(g)中,最稳定的物质一定是AB(g)16. 某科研团队成功利用阴离子合成某全氮类物质 , 下列说法正确的是( )A、1mol中含有电子数为70NA B、是离子化合物 C、中既含极性共价键也含非极性共价键 D、新合成的一种离子化合物中,其含有的五氮离子应该是二、填空题
-
17. 随原子序数递增,八种短周期元素(用字母x、y等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。回答下列问题:
 (1)、写出由d、e两种元素组成的淡黄色化合物与水反应的离子方程式:。(2)、f在元素周期表中的位置位于。(3)、写出f单质与e的最高价氧化物对应的水化物反应的离子方程式:。(4)、写出y、z、d的最简单氢化物的稳定性由强到弱的顺序(用化学式表示)。(5)、写出元素y用于测定文物年代的一种同位素的原子符号 , 该同位素形成的最高价氧化物69g中所含质子的数目为(用阿伏加德罗常数的值表示)。(6)、用电子式表示y的最高价氧化物的形成过程:。(7)、z的一种氢化物分子中既含非极性键又含极性键,其结构式为。
(1)、写出由d、e两种元素组成的淡黄色化合物与水反应的离子方程式:。(2)、f在元素周期表中的位置位于。(3)、写出f单质与e的最高价氧化物对应的水化物反应的离子方程式:。(4)、写出y、z、d的最简单氢化物的稳定性由强到弱的顺序(用化学式表示)。(5)、写出元素y用于测定文物年代的一种同位素的原子符号 , 该同位素形成的最高价氧化物69g中所含质子的数目为(用阿伏加德罗常数的值表示)。(6)、用电子式表示y的最高价氧化物的形成过程:。(7)、z的一种氢化物分子中既含非极性键又含极性键,其结构式为。三、综合题
-
18. 依据如下有关铝的三个装置图,回答问题。
 (1)、三个装置同时开始反应,单位时间内温度计示数最高的是(填“图Ⅰ”“图Ⅱ”或“图Ⅲ”)。(2)、写出图Ⅱ装置Al电极的电极反应式:;写出图Ⅲ装置正极的电极反应式:;写出图Ⅲ装置的总反应化学方程式:。(3)、图Ⅰ装置中为使生成氢气的速率加快,下列方法可行的是(填序号)。
(1)、三个装置同时开始反应,单位时间内温度计示数最高的是(填“图Ⅰ”“图Ⅱ”或“图Ⅲ”)。(2)、写出图Ⅱ装置Al电极的电极反应式:;写出图Ⅲ装置正极的电极反应式:;写出图Ⅲ装置的总反应化学方程式:。(3)、图Ⅰ装置中为使生成氢气的速率加快,下列方法可行的是(填序号)。①适当升高温度②把铝棒加粗
③将NaOH溶液换成浓硫酸④用铝碳合金代替铝棒
(4)、某同学欲收集和碘蒸气,在某绝热且体积固定的密闭容器中发生反应: , 下列叙述能证明该反应达到化学平衡状态的是(填序号)。
A.容器内温度不变
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.HI的体积分数不变
E.1mol键断裂的同时有2mol键生成现向容积为1L密闭容器中充入0.10mol和0.15mol , 在不同温度下测定同一时刻的转化率,结果如图。当温度为℃时,从反应开始经过2min达到b点,用表示这段时间的反应速率为 , 此时的转化率为(保留2位有效数字)。
19. 对甘蔗渣进行综合处理利用符合绿色化学理念,其处理流程图如下。已知D是一种植物生长调节剂,E由C在铜作催化剂的条件下被氧气氧化得到,G是具有香味的液体,回答下列问题: (1)、A的名称为 , 它水解得到最终产物的名称为。(2)、写出D生成C的化学反应方程式: , 此反应类型属于反应。(3)、写出F生成G的化学反应方程式: , 此反应类型属于反应。(4)、写出G的同分异构体中所有与互为同系物的结构简式:。(5)、写出流程图中除高分子化合物外有机物的含氧官能团名称:。20. 实验Ⅰ 从含碘废液(含有、、KI、)中回收碘,实验过程如图所示:
(1)、A的名称为 , 它水解得到最终产物的名称为。(2)、写出D生成C的化学反应方程式: , 此反应类型属于反应。(3)、写出F生成G的化学反应方程式: , 此反应类型属于反应。(4)、写出G的同分异构体中所有与互为同系物的结构简式:。(5)、写出流程图中除高分子化合物外有机物的含氧官能团名称:。20. 实验Ⅰ 从含碘废液(含有、、KI、)中回收碘,实验过程如图所示:
已知:①KI易溶于水,不溶于;②还原步骤中的反应:。
(1)、操作①的名称为;操作②的名称为。(2)、流程中“氧化”过程发生反应的离子方程式:。实验Ⅱ 海带中也含有丰富的碘元素,某同学设计从海带中提取碘单质实验流程如下:
 (3)、操作②中用到的主要玻璃仪器:。(4)、操作②中苯(填“能”或“不能”)换成有机溶剂酒精,原因是。(5)、实验Ⅰ和实验Ⅱ中,得到1mol , 消耗氧化剂物质的量之比。
(3)、操作②中用到的主要玻璃仪器:。(4)、操作②中苯(填“能”或“不能”)换成有机溶剂酒精,原因是。(5)、实验Ⅰ和实验Ⅱ中,得到1mol , 消耗氧化剂物质的量之比。
-