山东省聊城市2020-2021学年高二下学期期末考试化学试题
试卷更新日期:2022-06-16 类型:期末考试
一、单选题
-
1. 化学与生活、生产密切相关,下列说法错误的是( )A、淀粉、油脂、蛋白质均属于天然高分子化合物 B、用纤维素制造硝酸纤维,这一过程发生了酯化反应 C、医用酒精可用来消毒,是因为乙醇能使细菌蛋白发生变 D、苯酚具有消毒防腐作用,低浓度时可用作杀菌消毒剂
-
2. 下列化学用语错误的是( )A、2,3,3-三甲基丁烷 B、乙炔的电子式
 C、葡萄糖的实验式
D、空间填充模型
C、葡萄糖的实验式
D、空间填充模型 可以表示分子
可以表示分子
-
3. 下列叙述正确的是( )A、液晶是由分子较大、分子形状呈长形或碟形的物质形成的晶体 B、制造光导纤维的主要材料是高纯度硅,属于共价晶体 C、共价晶体中,共价键的键能越大,熔、沸点越高 D、硫化氢晶体和冰晶体升华时克服的作用力相同
-
4. 下列有关除杂或分离方法错误的是( )A、将乙烯和乙烷的混合气体通入溴的四氯化碳溶液除去乙烯 B、苯甲酸提纯采用重结晶的方法 C、用蒸馏的方法分离甲烷与氯气光照反应生成的液态有机混合物 D、使用分液漏斗分离乙醇、乙醛的混合物
-
5. 下列说法正确的是( )A、分子式符合通式且值不等的两种烃互为同系物 B、丙烯分子中共用电子对数为 C、用甘氨酸(
 )和丙氨酸(
)和丙氨酸( )缩合最多可形成3种二肽
D、分子式为且能发生银镜反应的有机物(不考虑立体异构)有4种
)缩合最多可形成3种二肽
D、分子式为且能发生银镜反应的有机物(不考虑立体异构)有4种
-
6.
 A BC
A BC  有关该合成路线下列说法正确的是( ) A、反应①的反应条件为氢氧化钠的水溶液、加热 B、有机化合物中所有碳原子不可能共平面 C、有机化合物和均含一个手性碳原子 D、反应③的反应类型为加成反应
有关该合成路线下列说法正确的是( ) A、反应①的反应条件为氢氧化钠的水溶液、加热 B、有机化合物中所有碳原子不可能共平面 C、有机化合物和均含一个手性碳原子 D、反应③的反应类型为加成反应 -
7. 钡在氧气中燃烧时得到一种钡的氧化物晶体,其晶胞的结构如图所示,下列有关说法中错误的是( )
 A、该晶体属于离子晶体 B、该晶体的晶胞结构与相似 C、晶体的化学式为 D、晶体中的配位数与的配位数之比为
A、该晶体属于离子晶体 B、该晶体的晶胞结构与相似 C、晶体的化学式为 D、晶体中的配位数与的配位数之比为 -
8. 下表中实验操作能达到实验目的的是( )
实验操作
实验目的
A
向苯酚浓溶液中滴加少量稀溴水
观察白色沉淀
B
向待测液中加入酸性高锰酸钾溶液
鉴别苯、甲苯
C
向溴乙烷中加氢氧化钠溶液并加热,冷却后再加硝酸银溶液
检验溴乙烷中的溴原子
D
向铁粉中依次加入苯和溴水
制备少量溴苯
A、A B、B C、C D、D -
9. 下列各组物质性质的比较,结论正确的是( )A、在水中的溶解度: B、羟基氢的活泼性:
 C、等质量的乙炔、苯完全燃烧耗氧量:乙炔<苯
D、沸点:
C、等质量的乙炔、苯完全燃烧耗氧量:乙炔<苯
D、沸点:
-
10. 紫花前胡醇(
 )可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述正确的是( ) A、分子式为 B、遇溶液发生显色反应 C、能够发生消去反应、取代反应、加成反应 D、含有4种含氧官能团
)可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述正确的是( ) A、分子式为 B、遇溶液发生显色反应 C、能够发生消去反应、取代反应、加成反应 D、含有4种含氧官能团 -
11. 乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是( )
A、反应①、④均为取代反应 B、反应②、③的原子利用率均为 C、乙醇、乙酸、乙酸乙酯三种无色液体可用溶液鉴别 D、与乙酸乙酯互为同分异构体的酯类化合物有2种 -
12. 实验室利用乙醇催化氧化制取粗乙醛的反应装置如图所示,关于实验操作或叙述错误的是( )
 A、实验过程中先点燃乙处酒精灯,然后通入干燥空气 B、该反应中铜为催化剂,硬质玻璃管中铜网出现红黑交替现象 C、试管中收集到的物质仅有乙醛、乙醇 D、甲烧杯中为热水,丙烧杯中为冰水
A、实验过程中先点燃乙处酒精灯,然后通入干燥空气 B、该反应中铜为催化剂,硬质玻璃管中铜网出现红黑交替现象 C、试管中收集到的物质仅有乙醛、乙醇 D、甲烧杯中为热水,丙烧杯中为冰水
二、多选题
-
13. 一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图

下列关于该高分子的说法正确的是( )
A、属于聚酯类合成高分子材料 B、完全水解产物的单个分子中,含有官能团或 C、合成该芳纶纤维的单体有两种 D、氢键不会影响该高分子的沸点、密度、硬度等性能 -
14. 下列说法错误的是( )A、晶体是蓝色的,因为与形成了 B、在晶体中,每个周围紧邻且距离相等的有6个 C、向含有的水溶液中加入足量溶液只能生成沉淀 D、在金刚石晶体中,碳原子数与碳碳键个数的比为
-
15. 科研人员提出催化合成需经历三步反应,示意图如图所示,下列说法正确的是( )
 A、与足量溶液反应,最多可消耗 B、合成的总反应为 C、①、②、③中均有的断裂 D、与互为同系物
A、与足量溶液反应,最多可消耗 B、合成的总反应为 C、①、②、③中均有的断裂 D、与互为同系物
三、综合题
-
16. 某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如图:
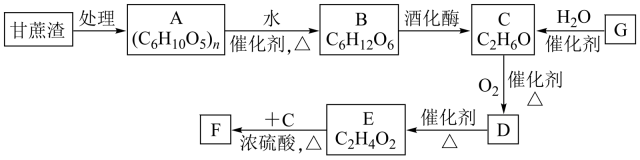
已知:石油裂解已成为生产的主要方法,是具有香味的液体。回答下列问题:
(1)、中的官能团的名称为 , 的反应类型为。(2)、的化学反应方程式为。(3)、下列化学试剂可以用来鉴别、的有。a. 酸性溶液 b. 溴水 c. 银氨溶液 d. 石蕊试液
(4)、实验室中制备的反应装置如图所示:
①与教材中采用的实验装置不同,此装置中采用了球形干燥管,其作用是。试管中加入的化学试剂是。
②若实验中用含的与反应则的化学方程式为。
-
17. 化合物是一种香料,可采用有机化合物与甲苯为主要原料,按下列路线合成:

已知:
请回答:
(1)、完全燃烧可产生和 , 的蒸气对的相对密度是22,核磁共振氢谐有2组峰,的结构简式为。(2)、的化学方程式。(3)、对于化合物 , 下列说法正确的是____。A、能发生水解反应 B、能使溶液褪色 C、能发生银镜反应(4)、芳香化合物是的同分异构体,则有种。 -
18. 丁酸龙葵酯是一种新型香料,一种合成路线如下:

已知:R-OH+

 +H2O
+H2O回答下列问题:
(1)、的名称为 , 反应④的反应类型为。(2)、试剂的结构简式为。(3)、由生成的化学方程式为。(4)、芳香化合物是的同分异构体,苯环上有2个取代基,能发生银镜反应。满足上述条件的的结构有种(不考虑立体异构),写出核磁共振氢谱为五组峰,峰面积比为的的结构简式。(5)、乙酸环己酯( )是一种食用香料,设计由环己烯,乙酸和过氧乙酸为原料制备乙酸环己酯的合成路线 (无机试剂任选)。
)是一种食用香料,设计由环己烯,乙酸和过氧乙酸为原料制备乙酸环己酯的合成路线 (无机试剂任选)。 -
19. 1-溴丙烷是一种重要的有机合成中间体,沸点为 , 密度为。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器中加入搅拌磁子、正丙醇及水,冰水冷却下缓慢加入浓;冷却至室温,搅拌下加入。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用、溶液和洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
 (1)、仪器的名称是 , 油浴加热的优点是。(2)、反应时生成的主要有机副产物有2-溴丙烷和(写名称)。(3)、步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是。(4)、写出步骤2中发生反应的化学方程式。(5)、1-溴丙烷的产率为(保留3位有效数字)。
(1)、仪器的名称是 , 油浴加热的优点是。(2)、反应时生成的主要有机副产物有2-溴丙烷和(写名称)。(3)、步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是。(4)、写出步骤2中发生反应的化学方程式。(5)、1-溴丙烷的产率为(保留3位有效数字)。 -
20. 自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。(1)、、同为金属氯化物,的熔点为而的熔点为 , 试分析原因。(2)、合成氨工业中,原料气(、及少量、的混合气)在进入合成塔前常用醋酸二氨合铜()溶液来吸收原料气体中的(代表),其反应是:醋酸羰基三氨合铜()配合物中心原子的配位数为 , 配位体为。(3)、铜的化合物种类很多,下图是氧化亚铜的晶胞结构,已知晶胞的棱长为。

①与最短的距离是 , 与紧邻的个数为。
②已知原子的坐标为 , 原子坐标为 , 则原子坐标为。
③氯化亚铜密度的计算式为(用表示阿伏加德罗常数)。
