山东省淄博市2020-2021学年高二下学期期末考试化学试题
试卷更新日期:2022-06-16 类型:期末考试
一、单选题
-
1. 2020年11月24日,我国用长征五号遥五运载火箭成功发射探月工程“嫦娥五号”探测器,开启我国首次地外天体采样返回之旅。下列有关说法错误的是( )A、制作降落伞使用的氮化硼纤维属于有机高分子材料 B、运载火箭发射常采用肼()、液氢等高能燃料 C、制作五星红旗用的芳纶为合成纤维 D、为落地后的返回器保温所贴的“暖宝宝”,主要成分含有铁粉和炭粉2. 化学与生产、生活和科技密切相关。下列有关说法错误的是( )A、核酸检测是确认病毒类型的有效手段,核酸是高分子化合物 B、葡萄糖具有还原性,可用来给人体提供能量 C、纳米铁粉和FeS都可以去除被污染水体中的、、等重金属离子,但原理不同 D、β-丙氨酸[]是由天然蛋白质水解得到的,既可以和酸反应,又可以和碱反应3. 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是( )
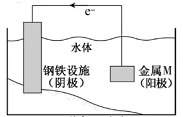 A、阴极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施表面因积累大量电子而被保护 D、钢铁设施在河水中的腐蚀速率比在海水中的快4. 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知 水溶液呈酸性,下列叙述正确的是( )A、 水溶液的 B、 水溶液加水稀释, 升高 C、 在水中的电离方程式为: D、 水溶液中:5. 草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )A、V(NaOH)= 0时,c(W)=1 × 10-2 mol/L B、V(NaOH)< 10 mL时,不可能存在c(Na+)=2 c(C2O)+ c(HC2O) C、V(NaOH)= 10 mL时,c(W)= 1 × 10-7mol/L D、V(NaOH)> 10 mL时,c(Na+)> c(C2O)>c(HC2O)6. H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法错误的是( )
A、阴极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施表面因积累大量电子而被保护 D、钢铁设施在河水中的腐蚀速率比在海水中的快4. 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知 水溶液呈酸性,下列叙述正确的是( )A、 水溶液的 B、 水溶液加水稀释, 升高 C、 在水中的电离方程式为: D、 水溶液中:5. 草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )A、V(NaOH)= 0时,c(W)=1 × 10-2 mol/L B、V(NaOH)< 10 mL时,不可能存在c(Na+)=2 c(C2O)+ c(HC2O) C、V(NaOH)= 10 mL时,c(W)= 1 × 10-7mol/L D、V(NaOH)> 10 mL时,c(Na+)> c(C2O)>c(HC2O)6. H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法错误的是( ) A、图甲表明,其他条件相同时,H2O2浓度越大,其分解速率越快 B、图乙表明,其他条件相同时,NaOH溶液浓度越小,H2O2分解速率越慢 C、图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 D、图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大7. 已知: , 向恒温恒容的密闭容器中充入1molA和2molB发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
A、图甲表明,其他条件相同时,H2O2浓度越大,其分解速率越快 B、图乙表明,其他条件相同时,NaOH溶液浓度越小,H2O2分解速率越慢 C、图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 D、图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大7. 已知: , 向恒温恒容的密闭容器中充入1molA和2molB发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( ) A、容器内压强不变,表明反应达到平衡 B、t2时改变的条件:向容器中加入C C、平衡常数K: D、平衡时A的体积分数:8. 乙炔在表面选择加氢的反应机理如图,其中吸附在表面上的物种用*标注。下列叙述错误的是( )
A、容器内压强不变,表明反应达到平衡 B、t2时改变的条件:向容器中加入C C、平衡常数K: D、平衡时A的体积分数:8. 乙炔在表面选择加氢的反应机理如图,其中吸附在表面上的物种用*标注。下列叙述错误的是( ) A、上述乙炔加氢的反应为放热反应 B、过程能量升高 C、反应历程中的活化能最大 D、总反应方程式:9. 25℃时,0.100mol/L二元弱酸(或其钠盐)用相同浓度的NaOH溶液(或盐酸)滴定,其pH与滴定分数(或)的关系如下图所示,下列说法正确的是( )
A、上述乙炔加氢的反应为放热反应 B、过程能量升高 C、反应历程中的活化能最大 D、总反应方程式:9. 25℃时,0.100mol/L二元弱酸(或其钠盐)用相同浓度的NaOH溶液(或盐酸)滴定,其pH与滴定分数(或)的关系如下图所示,下列说法正确的是( ) A、曲线①表示盐酸滴定溶液 B、25℃时, C、溶液中:a点比b点大 D、c点溶液中:
A、曲线①表示盐酸滴定溶液 B、25℃时, C、溶液中:a点比b点大 D、c点溶液中:二、多选题
-
10. 相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解溶液(a、b电极均为石墨电极),可以制得、、和NaOH。下列说法正确的是( )
 A、a电极的电极反应为: B、c、d离子交换膜依次为阴离子交换膜和阳离子交换膜 C、电池放电过程中,Cu(2)电极上的电极反应为 D、电池从开始工作到停止放电,电解池阳极区理论上可生成
A、a电极的电极反应为: B、c、d离子交换膜依次为阴离子交换膜和阳离子交换膜 C、电池放电过程中,Cu(2)电极上的电极反应为 D、电池从开始工作到停止放电,电解池阳极区理论上可生成三、综合题
-
11. 研究化学反应机理,就是研究化学反应的本质,是目前化学研究的重要方向。
把转化为HCOOH是降碳并生产化工原料的常用方法,有关反应如下:
①
②
③
(1)、反应:中(2)、温度为T1℃时,将等物质的量的和充入体积为1L的密闭容器中发生反应:K=2。实验测得: , , k正、k逆为速率常数。T1℃时,k逆=(以k正表示)。(3)、当温度改变为T2℃时,k正=2.1k逆 , 则T2℃T1℃(填“”或“”或“”),理由是。(4)、硫一碘循环分解水制氢主要涉及下列反应:①
②
③
下列判断正确的是____(填标号,下同)
A、反应③易在常温下进行 B、反应①中氧化性比HI强 C、循环过程中需补充 D、循环过程中产生的同时产生(5)、钌(Ru)的配合物[](L是一个基团)可催化甲醇脱氢,反应过程如图所示。下列叙述错误的是____。 A、2和4及均是反应的中间产物 B、甲醇脱氢反应为 C、反应过程中有极性键与非极性键的断裂与形成 D、增加的量可以增加化学反应速率并提高产物产率12. 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳的碳捕捉和碳利用技术则是关键。(1)、在恒容密闭容器中通入与 , 使其物质的量浓度均为1.0mol/L,在一定条件下发生反应: , 测得的平衡转化率与温度及压强的关系如图所示。
A、2和4及均是反应的中间产物 B、甲醇脱氢反应为 C、反应过程中有极性键与非极性键的断裂与形成 D、增加的量可以增加化学反应速率并提高产物产率12. 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳的碳捕捉和碳利用技术则是关键。(1)、在恒容密闭容器中通入与 , 使其物质的量浓度均为1.0mol/L,在一定条件下发生反应: , 测得的平衡转化率与温度及压强的关系如图所示。
①该反应的0(填“”或“”或“”)。
②压强p1、p2、p3、p4由大到小的关系为。
③压强为p4时,在b点:Kc(填“”或“”或“”)。
(2)、的催化加氢同时发生以下反应,如i
ii.
不同压强下的平衡转化率与温度的关系如下图:

①400~600℃,的平衡转化率随着压强的升高而增大,B点v正A点v逆 (填“>”或“<”或“=”)。
②根据图像可知,其他条件相同时,下列反应条件控制中能获得乙烯最多的是 (填序号)。
A.压强0.1MPa 温度800℃ B.压强4.0MPa 温度300℃
C.压强0.1MPa 温度300℃ D.压强4.0MPa 温度800℃
③在恒定压强下,随着温度的升高,的平衡转化率先降低后升高。试分析可能原因。
④一定条件下,将和CO2[]在某催化剂作用下,当总压稳定在p时,测得和CO的物质的量之比为2:1,的转化率为50.0%。则反应i的化学平衡常数Kp= (只列算式不计算)。
13. 聚酰亚胺是一类应用广泛的特种工程材料。某聚酰亚胺的合成路线如下:
已知:Ⅰ.


Ⅱ.
Ⅲ.CH3COOH

 + CH3COOH (R代表烃基)
+ CH3COOH (R代表烃基)请回答下列问题:
(1)、A的名称是 , A→B的化学反应方程式为。(2)、E→F的反应类型是 , 合成聚酰胺酸的反应类型是。(3)、聚酰胺酸中的官能团的名称是。(4)、写出聚酰亚胺的结构简式。(5)、A的同分异构体中含有苯环且核磁共振氢谱有三个峰的有种,其中能发生水解反应的是:(写出结构简式)(6)、以已二酸为原料制备聚己二酰丁二胺( , 又称尼龙46)的合成路线(无机试剂任选) 14. 电化学普遍应用于生活和生产中,前途广泛,是科研的重点方向。(1)、为处理银器表面的黑斑(),将银器置于铝制容器里的食盐水中并与铝接触,可转化为Ag。食盐水的作用为。(2)、用原电池原理可以除去酸性废水中的三氯乙烯和 , 其原理如图所示(导电壳内部为纳米铁)。
, 又称尼龙46)的合成路线(无机试剂任选) 14. 电化学普遍应用于生活和生产中,前途广泛,是科研的重点方向。(1)、为处理银器表面的黑斑(),将银器置于铝制容器里的食盐水中并与铝接触,可转化为Ag。食盐水的作用为。(2)、用原电池原理可以除去酸性废水中的三氯乙烯和 , 其原理如图所示(导电壳内部为纳米铁)。
①正极电极反应式为:。
②在标准状况下,当电路中有0.4mol电子转移时,就会有L乙烷生成。
(3)、一种钾离子电池的工作原理如图所示。
①放电时通过阳离子交换膜向电极移动(填“石墨”或“”)。
②充电时,阳极的电极反应式为:。
(4)、已知双极膜是一种复合膜,在电场作用下双极膜中间界面内水解离为和并实现其定向通过。用下图所示的电化学装置合成重要的化工中间体乙醛酸。
①阴极电极反应式为。
②其中的作用是。
③制得2mol乙醛酸,理论上外电路中迁移了mol电子。
15. 电解质的溶液中存在着众多的化学平衡。(1)、25℃时向浓度均为0.1mol/L的和混合溶液中逐滴加入氨水,首先生成沉淀的离子方程式为。已知 , 。当两种沉淀共存时,。(2)、25℃时,电离常数 , , 则该温度下的水解平衡常数Kh=mol/L(水解平衡常数Kh的书写规则同化学平衡常数)。(3)、在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中 , 则溶液显性(填“酸”或“碱”或“中”);用含a的代数式表示的电离常数Kb=。(4)、 25℃时向含有的溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为mol/L。(的电离平衡常数取)(5)、向废水中加入硫化物可以依次获得CuS、ZnS纳米粒子。常温下,的 , , 溶液中平衡时相关离子浓度的关系如图,下列说法正确的是。
a. 的数量级为
b. a点对应的CuS溶液为不饱和溶液
c. 平衡常数很大,反应趋于完全
d. 向p点的溶液中加入少量固体,溶液组成由p向q方向移动
-