山东省济南市2020-2021学年高一下学期期末考试化学试题
试卷更新日期:2022-06-16 类型:期末考试
一、单选题
-
1. 2021年5月1日《济南市生活垃圾减量与分类管理条例》正式实施。下列垃圾分类对应错误的是( )




A.鸡蛋壳、花卉绿植
B.使用后的一次性口罩
C.废旧镍镉电池、过期药品
D.污损塑料袋、餐巾纸
A、A B、B C、C D、D2. 《内经》曰:“五谷为养,五果为助,五畜为益,五菜为充”。合理膳食,能提高免疫力。下列说法正确的是( )A、淀粉和纤维素都属于天然高分子,且两者互为同分异构体 B、植物油中含有不饱和脂肪酸酯,能使溴的四氯化碳溶液褪色 C、淀粉通过发酵法制得的乳酸[]是乙酸的同系物 D、食盐水可以破坏蛋白质结构,用盐水漱口可以杀灭新型冠状病毒3. 化学科学需要借助化学专用语言描述。下列有关化学用语正确的是( )A、的电子式: B、分子的空间填充模型:
B、分子的空间填充模型: C、乙烯的结构简式:
D、中子数为20的氯原子:20Cl
4. 表示阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,含有的共用电子对数为2 B、和在一定条件下充分反应后,生成分子的数目为2 C、28g乙烯和丙烯的混合气体完全燃烧,消耗的分子数为3 D、乙醇中的官能团为羟基,1mol羟基中含有的电子数为105. 在实验室制备并获得乙酸乙酯粗产品的实验过程中,下列操作未涉及的是( )
C、乙烯的结构简式:
D、中子数为20的氯原子:20Cl
4. 表示阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,含有的共用电子对数为2 B、和在一定条件下充分反应后,生成分子的数目为2 C、28g乙烯和丙烯的混合气体完全燃烧,消耗的分子数为3 D、乙醇中的官能团为羟基,1mol羟基中含有的电子数为105. 在实验室制备并获得乙酸乙酯粗产品的实验过程中,下列操作未涉及的是( )



A
B
C
D
A、A B、B C、C D、D6. 氢氧燃料电池可以使用在航天飞机上,其反应原理如图。下列说法正确的是( ) A、该电池的总反应: B、该电池工作时电能转化为化学能 C、外电路中电子由电极b通过导线流向电极a D、该电池的离子导体可以选择稀硫酸,也可选择酒精溶液7. 中国研究人员研制出一种新型复合光催化剂,可以利用太阳光在催化剂表面实现高效分解水,主要过程如图所示,下列说法错误的是( )
A、该电池的总反应: B、该电池工作时电能转化为化学能 C、外电路中电子由电极b通过导线流向电极a D、该电池的离子导体可以选择稀硫酸,也可选择酒精溶液7. 中国研究人员研制出一种新型复合光催化剂,可以利用太阳光在催化剂表面实现高效分解水,主要过程如图所示,下列说法错误的是( ) A、上述过程中,反应物的总能量小于生成物的总能量 B、上述过程中,太阳能转化为化学能 C、过程Ⅰ释放能量,过程Ⅱ吸收能量 D、过程Ⅲ属于氧化还原反应8. X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的,X、Y、Z、W形成的化合物可表示为。下列说法正确的是( )A、元素的最高正化合价: B、气态氢化物的热稳定性: C、化合物与中的阴、阳离子个数比都为 D、X、Y、Z形成的化合物一定为共价化合物9. 一定温度下,恒容密闭容器中发生反应。下列说法能够判断该反应已达到化学平衡状态的是( )A、与的浓度相等 B、混合气体的压强不再变化 C、混合气体的密度不再变化 D、相同时间内,消耗的同时产生10. 绿原酸()是一种有机弱酸,金银花的水浸取液经下列操作可获得绿原酸粗品。下列说法错误的是( )
A、上述过程中,反应物的总能量小于生成物的总能量 B、上述过程中,太阳能转化为化学能 C、过程Ⅰ释放能量,过程Ⅱ吸收能量 D、过程Ⅲ属于氧化还原反应8. X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的,X、Y、Z、W形成的化合物可表示为。下列说法正确的是( )A、元素的最高正化合价: B、气态氢化物的热稳定性: C、化合物与中的阴、阳离子个数比都为 D、X、Y、Z形成的化合物一定为共价化合物9. 一定温度下,恒容密闭容器中发生反应。下列说法能够判断该反应已达到化学平衡状态的是( )A、与的浓度相等 B、混合气体的压强不再变化 C、混合气体的密度不再变化 D、相同时间内,消耗的同时产生10. 绿原酸()是一种有机弱酸,金银花的水浸取液经下列操作可获得绿原酸粗品。下列说法错误的是( ) A、该流程中乙酸乙酯可循环利用 B、萃取振荡时,分液漏斗下口应倾斜向上 C、分液时,应先从分液漏斗的下口放出下层液体,然后再放出上层液体 D、蒸馏时选用直形冷凝管,且冷凝水从下口进,上口出11. 全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。中国科学家成功合成全氮阴离子N , N是全氮类物质NN的重要中间体。下列说法中错误的是( )A、全氮类物质属于绿色能源 B、每个N中含有36个质子 C、NN属于离子化合物 D、NN结构中含有离子键和共价键12. 阿司匹林是影响人类历史进程和走向的化学药品,其化学名称为乙酰水杨酸(结构如图)。下列关于乙酰水杨酸的说法正确的是( )
A、该流程中乙酸乙酯可循环利用 B、萃取振荡时,分液漏斗下口应倾斜向上 C、分液时,应先从分液漏斗的下口放出下层液体,然后再放出上层液体 D、蒸馏时选用直形冷凝管,且冷凝水从下口进,上口出11. 全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。中国科学家成功合成全氮阴离子N , N是全氮类物质NN的重要中间体。下列说法中错误的是( )A、全氮类物质属于绿色能源 B、每个N中含有36个质子 C、NN属于离子化合物 D、NN结构中含有离子键和共价键12. 阿司匹林是影响人类历史进程和走向的化学药品,其化学名称为乙酰水杨酸(结构如图)。下列关于乙酰水杨酸的说法正确的是( ) A、分子式为 B、能与乙醇发生酯化反应 C、分子中含有3种官能团 D、1mol乙酰水杨酸与足量的Na反应生成13. 某化学小组欲测定酸性条件下溶液与溶液反应的化学反应速率,所用的试剂为溶液和溶液,所得随时间变化的曲线如图所示。下列说法错误的是( )
A、分子式为 B、能与乙醇发生酯化反应 C、分子中含有3种官能团 D、1mol乙酰水杨酸与足量的Na反应生成13. 某化学小组欲测定酸性条件下溶液与溶液反应的化学反应速率,所用的试剂为溶液和溶液,所得随时间变化的曲线如图所示。下列说法错误的是( )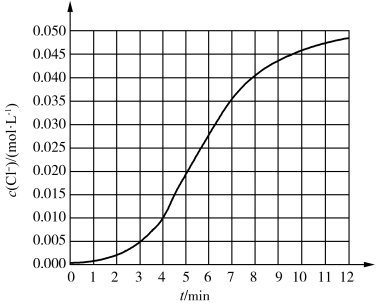 A、该反应的离子方程式为 B、该反应在的平均反应速率 C、在反应过程中,该反应的化学反应速率变化趋势为先增大后减小 D、起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
A、该反应的离子方程式为 B、该反应在的平均反应速率 C、在反应过程中,该反应的化学反应速率变化趋势为先增大后减小 D、起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果二、多选题
-
14. 将溶液和溶液混合,取混合液分别完成下列实验,能说明溶液中存在化学平衡“”的实验组合是( )
实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入溶液
有黄色沉淀生成
③
滴入溶液
有蓝色沉淀生成
④
滴入淀粉溶液
溶液变蓝色
已知:与反应生成蓝色沉淀,可用于的检验。
A、①和④ B、②和④ C、③和④ D、①和③15. 某研究性学习小组从腐蚀印刷电路板的废液(含有、、)中回收铜并制备氯化铁晶体,设计流程如图。下列说过法正确的是( ) A、试剂a是铁粉、试剂b是稀硫酸 B、操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒 C、操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥 D、可用KSCN溶液和新制氯水检验溶液W中是否含有
A、试剂a是铁粉、试剂b是稀硫酸 B、操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒 C、操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥 D、可用KSCN溶液和新制氯水检验溶液W中是否含有三、综合题
-
16. A、B、D、E、G为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B原子的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物 , 与具有相同的电子层结构。A单质在G单质中燃烧,产物溶于水得到一种强酸。回答下列问题:(1)、G在元素周期表中的位置是 , 的电子式为;(2)、D、E、G分别形成的简单离子的半径由大到小的顺序为(用离子符号表示);(3)、由A、D、E三种元素组成的化合物含有的化学键类型为;(4)、设计一个简单的实验证明G和B的非金属性强弱:(用化学方程式表示)。17. 氨是一种重要的化工原料,主要用于化肥、纯碱、硝酸等工业。回答下列问题:(1)、某同学在实验室中,欲用下图装置制备并收集一瓶干燥的氨气。

①实验室利用和制备氨气的化学方程式为;
②欲用上述方法收集一瓶干燥的氨气,装置连接顺序为a→;
(2)、工业合成氨的反应是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂1mol相应化学键需要的能量如下:化学键
H-H
N-H
能量
436kJ
391kJ
946kJ
若反应生成 , 可(填“吸收”或“放出”)热量kJ;
(3)、电化学气敏传感器可用于监测环境中的含量,其工作原理如图。
①离子导体中,向Pt电极(填“a”或“b”)移动;
②写出Pt电极(b)上的电极反应式:。
18. 很多重要的化工原料都来源于石油,模拟石油深加工合成丙烯酸乙酯等化工原料的过程如下:
回答下列问题:
(1)、A→B的反应类型为;(2)、丙烯酸中含有的官能团的名称为;(3)、丙烯分子中,最多有个原子共平面;(4)、已知石蜡油的分解产物中除含有A、丙烯外,还可能含有等有机物。的一氯代物有种;(5)、写出反应②的化学方程式;(6)、聚丙烯酸可用于配制某些高档商品的涂饰剂、制取丙烯酸树脂漆等。写出聚丙烯酸的结构简式:。19. 碘是人体必需的元素之一,海带中含有丰富的碘元素。灼烧海带获取的海带灰中,碘元素主要以形式存在。在实验室中,从海带灰中提取碘的流程如下:
回答下列问题:
(1)、实验室灼烧海带的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、等;(2)、指出上述提取碘的过程中有关实验操作的名称:步骤② , 步骤⑤;(3)、写出步骤①中发生反应的离子方程式:;(4)、步骤②中提取碘的过程中,可选择的有机试剂是____(填编号);A、酒精 B、醋酸 C、四氯化碳 D、苯(5)、写出步骤④中发生反应的离子方程式: , 在此反应中,每生成转移mol电子;(6)、上述流程中,含的水溶液经3步转化为含的悬浊液,主要目的是。