辽宁省锦州市2020-2021学年高二下学期期末考试化学试题
试卷更新日期:2022-06-16 类型:期末考试
一、单选题
-
1. 下列物质不属于高分子的是( )A、纤维素 B、核糖 C、蛋白质 D、核酸2. 下列各组物质之间,互为同系物的是( )A、乙二醇与丙三醇 B、C2H4与C2H2 C、C2H6与C4H10 D、苯与苯酚3. 采用现代仪器分析方法,可以快速、准确地测定有机化合物的分子结构。某有机化合物的谱图如下,推测其结构简式为( )

 A、 B、 C、 D、4. 向盛有硝酸银溶液的试管中加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到无色透明溶液,下列说法正确的是( )A、反应后溶液中没有沉淀,所以反应前后的浓度不变 B、沉淀溶解后,生成的难电离 C、在中,给出孤对电子,提供空轨道 D、该实验能证明比稳定5. 用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
A、 B、 C、 D、4. 向盛有硝酸银溶液的试管中加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到无色透明溶液,下列说法正确的是( )A、反应后溶液中没有沉淀,所以反应前后的浓度不变 B、沉淀溶解后,生成的难电离 C、在中,给出孤对电子,提供空轨道 D、该实验能证明比稳定5. 用下列实验装置进行相应实验,设计正确且能达到实验目的的是( ) A、用甲装置除去苯中的苯酚杂质 B、用乙装置验证硫酸、碳酸、苯酚的酸性强弱 C、用丙装置制备并检验乙炔的性质 D、用丁装置分离乙醇和乙酸的混合物6. 下列说法错误的是( )A、甲酸、葡萄糖均能在加热条件下与银氨溶液反应 B、等质量的乙烯、二甲醚完全燃烧耗氧量一定不相同 C、-氨基酸均含有手性碳原子,具有对映异构体 D、聚丙烯酸钠(
A、用甲装置除去苯中的苯酚杂质 B、用乙装置验证硫酸、碳酸、苯酚的酸性强弱 C、用丙装置制备并检验乙炔的性质 D、用丁装置分离乙醇和乙酸的混合物6. 下列说法错误的是( )A、甲酸、葡萄糖均能在加热条件下与银氨溶液反应 B、等质量的乙烯、二甲醚完全燃烧耗氧量一定不相同 C、-氨基酸均含有手性碳原子,具有对映异构体 D、聚丙烯酸钠( )具有很强吸水性的原因是有亲水基团的存在
7. 下列各项前后两个反应的反应类型相同的是( )A、乙酸乙酯与稀硫酸混合水浴加热,氯乙烷与水溶液共热 B、乙醇与浓硫酸共热至 , 乙醛与新制悬浊液共热 C、乙醇通过灼热的氧化铜粉末,氯乙烯制备聚氯乙烯 D、乙烯使澳水褪色,乙醛使酸性高锰酸钾溶液褪色8. 用KMnO4氧化甲苯制备苯甲酸。实验方法:将甲苯和KMnO4溶液在100 ℃下反应一段时间后停止反应,过滤,将含有苯甲酸钾(C6H5COOK)和甲苯的滤液按如下流程分离苯甲酸并回收未反应的甲苯。
)具有很强吸水性的原因是有亲水基团的存在
7. 下列各项前后两个反应的反应类型相同的是( )A、乙酸乙酯与稀硫酸混合水浴加热,氯乙烷与水溶液共热 B、乙醇与浓硫酸共热至 , 乙醛与新制悬浊液共热 C、乙醇通过灼热的氧化铜粉末,氯乙烯制备聚氯乙烯 D、乙烯使澳水褪色,乙醛使酸性高锰酸钾溶液褪色8. 用KMnO4氧化甲苯制备苯甲酸。实验方法:将甲苯和KMnO4溶液在100 ℃下反应一段时间后停止反应,过滤,将含有苯甲酸钾(C6H5COOK)和甲苯的滤液按如下流程分离苯甲酸并回收未反应的甲苯。
下列说法正确的是( )
A、无色液体A是苯甲酸,白色固体B是甲苯 B、操作Ⅰ的名称为蒸馏,操作Ⅱ的名称为分液 C、加入浓盐酸酸化的目的是将苯甲酸钾转化为产物 D、为了得到更多的白色固体B,冷却结晶时温度越低越好9. 下列选项中,根据实验操作和实验现象,能得出对应实验结论的是( )选项
实验操作
实验现象
实验结论
A
淀粉溶液中加入稀硫酸,加热一段时间,冷却后,向溶液中加入碘水
溶液没有变成蓝色
淀粉完全水解
B
向填充有经过硫酸处理的硅胶导管中吹入乙醇蒸气
固体由橙色变为绿色
乙醇具有氧化性
C
向蛋白质溶液中加入饱和氯化钠溶液
有白色沉淀产生
蛋白质发生了变性
D
向苯和液溴的混合物中加入铁粉,将产生气体通入硝酸银溶液中
有淡黄色沉淀产生
苯与溴发生了取代反应
A、A B、B C、C D、D10. 分子式为C8H8O2 , 含有苯环且能发生水解反应的同分异构体共有( )A、5种 B、6种 C、7种 D、8种11. 下列说法正确的组合是( )①晶体在不同方向上的硬度、导热性、导电性相同
②离子晶体都是化合物
③共价晶体中,共价键越强,熔点越高
④分子晶体中,分子间作用力越大,对应的物质越稳定
⑤金属晶体能导电的原因是在外加电场作用下可失去电子
⑥分子识别是超分子的重要特征之一
A、①②③ B、①④⑤ C、②③⑥ D、②④⑥12. 有机物分子中基团间的相互影响会导致化学性质不同。下列各项事实不能说明上述观点的是( )A、乙醛能与氢气加成,而乙酸不能 B、2-丙醇能被催化氧化,而2-甲基-2-丙醇不能 C、 分子中键的易断裂程度:3>1>2
D、苯在时发生硝化反应,而甲苯在时即可反应
13. 下列说法错误的是( )
分子中键的易断裂程度:3>1>2
D、苯在时发生硝化反应,而甲苯在时即可反应
13. 下列说法错误的是( ) A、干冰晶体中,含有晶胞结构单元 B、硅晶体中,最小的环上有6个原子 C、氯化钠晶体中,距最近的有6个 D、石墨晶体中,每个六元环占有2个原子14. 莲花清瘟胶囊对于治疗新冠肺炎有确切的疗效,其有效成分绿原酸的结构简式如下图所示。下列有关绿原酸说法正确的是( )
A、干冰晶体中,含有晶胞结构单元 B、硅晶体中,最小的环上有6个原子 C、氯化钠晶体中,距最近的有6个 D、石墨晶体中,每个六元环占有2个原子14. 莲花清瘟胶囊对于治疗新冠肺炎有确切的疗效,其有效成分绿原酸的结构简式如下图所示。下列有关绿原酸说法正确的是( ) A、所有碳原子均可能共平面 B、绿原酸与足量反应,最多可消耗 C、与等量绿原酸反应时,所需、的物质的量之比是 D、能发生酯化、加成、消去、氧化、加聚反应15. 维纶是聚乙烯醇缩甲醛纤维的商品名,其合成路线如下,下列说法正确的是( )
A、所有碳原子均可能共平面 B、绿原酸与足量反应,最多可消耗 C、与等量绿原酸反应时,所需、的物质的量之比是 D、能发生酯化、加成、消去、氧化、加聚反应15. 维纶是聚乙烯醇缩甲醛纤维的商品名,其合成路线如下,下列说法正确的是( ) A、①的反应类型为缩聚反应 B、高分子A的链节中含有两种官能团 C、高分子B中碳原子均为杂化 D、③的化学方程式为:
A、①的反应类型为缩聚反应 B、高分子A的链节中含有两种官能团 C、高分子B中碳原子均为杂化 D、③的化学方程式为: +nHCHO
+nHCHO +(2n-1)H2O
+(2n-1)H2O
二、填空题
-
16. 现有如下6种有机物,请回答下列问题:
①
 ②
② ③ ④2-丁烯 ⑤合成纤维 ⑥
③ ④2-丁烯 ⑤合成纤维 ⑥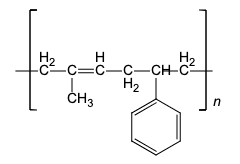 (1)、①中虚线内官能团的名称为。(2)、②的分子式为。(3)、③的系统命名法的名称为。(4)、④的顺式结构的结构简式为。(5)、⑤在生活或工业中的一种用途为。(6)、⑥的单体的结构简式分别为。
(1)、①中虚线内官能团的名称为。(2)、②的分子式为。(3)、③的系统命名法的名称为。(4)、④的顺式结构的结构简式为。(5)、⑤在生活或工业中的一种用途为。(6)、⑥的单体的结构简式分别为。三、综合题
-
17. 晶体和配合物等物质在生活生产中具有广泛应用。请回答下列问题:(1)、按构成晶体的粒子与粒子间作用力的不同,将以下晶体进行分类:
①氧化钙 ②金刚砂 ③锌 ④高锰酸钾 ⑤白磷 ⑥硼 ⑦尿素 ⑧干冰 ⑨石墨 ⑩碳钢
属于分子晶体的是(填序号);属于共价晶体的是(填序号)。
(2)、中,配位数为;以原子与形成配位键,请在结构示意图的相应位置填补缺少的配体。 (3)、铁和氮形成一种晶体,晶胞结构如图所示。则该晶体中每个周围与它最接近且距离相等的共有个;若该晶体的密度为 , 用表示阿伏加德罗常数的值,则该晶胞的体积是。18. 某化学小组依据实验室制备乙烯的原理,利用如图装置,用环己醇制备环己烯(不考虑副反应)。请回答下列问题:
(3)、铁和氮形成一种晶体,晶胞结构如图所示。则该晶体中每个周围与它最接近且距离相等的共有个;若该晶体的密度为 , 用表示阿伏加德罗常数的值,则该晶胞的体积是。18. 某化学小组依据实验室制备乙烯的原理,利用如图装置,用环己醇制备环己烯(不考虑副反应)。请回答下列问题:
已知:I.

 +H2O
+H2OⅡ.相关有机物的物理性质如下:
密度()
熔点/
沸点/
溶解性
环己醇
0.96
25
161
能溶于水
环己烯
0.81
-103
83
难溶于水
(1)、制备粗品:将环己醇加入试管A中,再加入浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是。
②试管C置于冰水浴中的目的是。
(2)、制备精品:①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置后,环己烯在(填“上层”、“下层”或“不分层”),分离后再用(填标号)洗涤可得较纯净的环己烯样品。
a.溶液 b.稀 c.饱和溶液
②将较纯净环己烯样品按如图装置蒸馏,冷却水应从口(填“d”或“e”)进入。
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,试分析可能的原因是(填标号)。
a.蒸馏时从开始收集产品
b.环己醇的实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)、若最终收集到环己烯产品,则该实验的产率为%(精确到小数点后1位)。19. 醇酸树脂的附着力强,并具有良好的耐磨性、绝缘性等。下图是一种醇酸树脂G的合成路线,请回答下列问题:
已知:RCH2CH=CH2
 (1)、反应①的反应条件为。(2)、反应②的反应类型为。(3)、D中含有官能团的名称为。(4)、合成G过程中会生成另一种醇酸树脂,其结构简式为。(5)、反应④的化学方程式为。(6)、任意写出一种符合下列条件的F的同分异构体的结构简式(不考虑立体异构)。
(1)、反应①的反应条件为。(2)、反应②的反应类型为。(3)、D中含有官能团的名称为。(4)、合成G过程中会生成另一种醇酸树脂,其结构简式为。(5)、反应④的化学方程式为。(6)、任意写出一种符合下列条件的F的同分异构体的结构简式(不考虑立体异构)。a.该物质与新制悬浊液反应
b.遇溶液显紫色
c.核磁共振氢谱有3组峰,比值为
(7)、设计以1-溴丙烷()为原料制备聚丙烯醇( )的合成路线(用流程图表示,无机试剂任选,反应条件合理)。
)的合成路线(用流程图表示,无机试剂任选,反应条件合理)。
-