【高考真题】2022年高考理综化学真题试卷(全国乙卷)
试卷更新日期:2022-06-10 类型:高考真卷
一、选择题
-
1. 生活中处处有化学,下列叙述正确的是( )A、铅笔芯的成分为二氧化铅 B、碳酸氢钠可做食品膨松剂 C、青铜和黄铜是不同结构的单质铜 D、焰火中红色来源于钠盐灼烧2. 一种实现二氧化碳固定及再利用的反应如下:
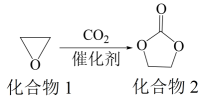
下列叙述正确的是( )
A、化合物1分子中的所有原子共平面 B、化合物1与乙醇互为同系物 C、化合物2分子中含有羟基和酯基 D、化合物2可以发生开环聚合反应3. 某白色粉末样品,可能含有、、和 . 取少量样品进行如下实验:①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出.离心分离.
③取②的上层清液,向其中滴加溶液有沉淀生成.
该样品中确定存在的是( )
A、 B、 C、 D、4. 由实验操作和现象,可得出相应正确结论的是( )实验操作
现象
结论
A
向溶液中滴加过量氯水,再加入淀粉溶液
先变橙色,后变蓝色
氧化性:
B
向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的悬浊液
无砖红色沉淀
蔗糖未发生水解
C
石蜡油加强热,将产生的气体通入的溶液
溶液红棕色变无色
气体中含有不饱和烃
D
加热试管中的聚氯乙烯薄膜碎片
试管口润湿的蓝色石蕊试纸变红
氯乙烯加聚是可逆反应
A、A B、B C、C D、D5. 化合物可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在以下热分解时无刺激性气体逸出。下列叙述正确的是( )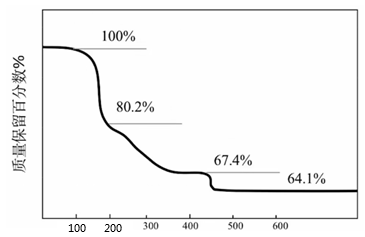 A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物6. 电池比能量高,在汽车、航天等领域具有良好的应用前景.近年来科学家研究了一种光照充电电池(如图所示).光照时,光催化电极产生电子和空穴 , 驱动阴极反应和阳极反应对电池进行充电.下列叙述错误的是( )
A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物6. 电池比能量高,在汽车、航天等领域具有良好的应用前景.近年来科学家研究了一种光照充电电池(如图所示).光照时,光催化电极产生电子和空穴 , 驱动阴极反应和阳极反应对电池进行充电.下列叙述错误的是( ) A、充电时,电池的总反应 B、充电效率与光照产生的电子和空穴量有关 C、放电时,从正极穿过离子交换膜向负极迁移 D、放电时,正极发生反应7. 常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
A、充电时,电池的总反应 B、充电效率与光照产生的电子和空穴量有关 C、放电时,从正极穿过离子交换膜向负极迁移 D、放电时,正极发生反应7. 常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。
设溶液中 , 当达到平衡时,下列叙述正确的是( )
A、溶液Ⅰ中 B、溶液Ⅱ中的的电离度为 C、溶液Ⅰ和Ⅱ中的不相等 D、溶液Ⅰ和Ⅱ中的之比为二、非选择题
-
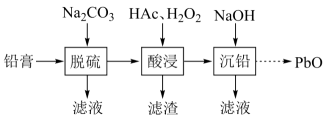
8. 废旧铅蓄电池的铅膏中主要含有、、和 , 还有少量、、的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物
开始沉淀的
2.3
6.8
3.5
7.2
完全沉淀的
3.2
8.3
4.6
9.1
回答下列问题:
(1)、在“脱硫”中转化反应的离子方程式为 , 用沉淀溶解平衡原理解释选择的原因。(2)、在“脱硫”中,加入不能使铅膏中完全转化,原因是。(3)、在“酸浸”中,除加入醋酸(),还要加入。(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属在醋酸中转化为 , 其化学方程式为;
(ⅲ)也能使转化为 , 的作用是。
(4)、“酸浸”后溶液的约为4.9,滤渣的主要成分是。(5)、“沉铅”的滤液中,金属离子有。9. 二草酸合铜(Ⅱ)酸钾()可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:Ⅰ.取已知浓度的溶液,搅拌下滴加足量溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸()溶液中加入适量固体,制得和混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)、由配制Ⅰ中的溶液,下列仪器中不需要的是(填仪器名称)。 (2)、长期存放的中,会出现少量白色固体,原因是。(3)、Ⅰ中的黑色沉淀是(写化学式)。(4)、Ⅱ中原料配比为 , 写出反应的化学方程式。(5)、Ⅱ中,为防止反应过于剧烈而引起喷溅,加入应采取的方法。(6)、Ⅲ中应采用进行加热。(7)、Ⅳ中“一系列操作”包括。10. 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(1)、已知下列反应的热化学方程式:
(2)、长期存放的中,会出现少量白色固体,原因是。(3)、Ⅰ中的黑色沉淀是(写化学式)。(4)、Ⅱ中原料配比为 , 写出反应的化学方程式。(5)、Ⅱ中,为防止反应过于剧烈而引起喷溅,加入应采取的方法。(6)、Ⅲ中应采用进行加热。(7)、Ⅳ中“一系列操作”包括。10. 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(1)、已知下列反应的热化学方程式:①
②
③
计算热分解反应④的。
(2)、较普遍采用的处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解。相比克劳斯工艺,高温热分解方法的优点是 , 缺点是。(3)、在、反应条件下,将的混合气进行热分解反应。平衡时混合气中与的分压相等,平衡转化率为 , 平衡常数。(4)、在、反应条件下,对于分别为、、、、的混合气,热分解反应过程中转化率随时间的变化如下图所示。
①越小,平衡转化率 , 理由是。
②对应图中曲线 , 计算其在之间,分压的平均变化率为。
11. [化学——选修3:物质结构与性质]卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)、氟原子激发态的电子排布式有 , 其中能量较高的是。(填标号)a. b. c. d.
(2)、①一氯乙烯分子中,C的一个杂化轨道与的轨道形成键,并且的轨道与C的轨道形成3中心4电子的大键。②一氯乙烷、一氯乙烯、一氯乙炔分子中,键长的顺序是 , 理由:(ⅰ)C的杂化轨道中s成分越多,形成的键越强;(ⅱ)。
(3)、卤化物受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为。解释X的熔点比Y高的原因。(4)、晶体中离子作体心立方堆积(如图所示),主要分布在由构成的四面体、八面体等空隙中。在电场作用下,不需要克服太大的阻力即可发生迁移。因此,晶体在电池中可作为。
已知阿伏加德罗常数为 , 则晶体的摩尔体积(列出算式)。
12. [化学——选修5:有机化学基础]左旋米那普伦是治疗成人重度抑郁症的药物之一,以下是其盐酸盐(化合物K)的一种合成路线(部分反应条件已简化,忽略立体化学):

已知:化合物F不能与饱和碳酸氢钠溶液反应产生二氧化碳。
回答下列问题:
(1)、A的化学名称是。(2)、C的结构简式为。(3)、写出由E生成F反应的化学方程式。(4)、E中含氧官能团的名称为。(5)、由G生成H的反应类型为。(6)、I是一种有机物形成的盐,结构简式为。(7)、在E的同分异构体中,同时满足下列条件的总数为种。a)含有一个苯环和三个甲基;
b)与饱和碳酸氢钠溶液反应产生二氧化碳;
c)能发生银镜反应,不能发生水解反应。
上述同分异构体经银镜反应后酸化,所得产物中,核磁共振氢谱显示有四组氢(氢原子数量比为6∶3∶2∶1)的结构简式为。