山东省潍坊市2022届高三下学期5月模拟考试(一)化学试题
试卷更新日期:2022-06-09 类型:高考模拟
一、单选题
-
1. 2021年我国航天事业取得了举世瞩目的科技成果,化学功不可没。下列说法错误的是( )A、“天和核心舱”电推进系统腔体的氮化硼陶瓷属于新型无机非金属材料 B、“北斗系统”装载高精度铷原子钟搭配铯原子钟,铷和铯属于同系物 C、航天服面窗的复合材料具有高抗冲击性、高防辐射性、高光谱透过率等优良性能 D、“嫦娥五号”成功着陆月球,运载火箭使用了煤油液氧推进剂,煤油可由石油分馏得到2. 北京冬奥会“冰墩墩”“雪容融”成为顶流,由PVC、PC、ABS和亚克力等环保材料制作而成。下列说法错误的是( )
 A、PVC(
A、PVC( )的单体为氯乙烯
B、PC(
)的单体为氯乙烯
B、PC( )中所有碳原子均可共面
C、ABS的单体之一苯乙烯能使溴水褪色
D、亚克力(
)中所有碳原子均可共面
C、ABS的单体之一苯乙烯能使溴水褪色
D、亚克力( )可通过加聚反应制备
3. 下列做法或实验(图中部分夹持略),不能达到目的的是( )
)可通过加聚反应制备
3. 下列做法或实验(图中部分夹持略),不能达到目的的是( )防止铁管道被腐蚀
检验产生的SO2
模拟侯氏制碱法:a先通入NH3 , b中再通入CO2 , c放蘸有稀硫酸的脱脂棉
测量气体体积时,减少误差




A
B
C
D
A、A B、B C、C D、D4. 一种抗血小板聚集的药物X的结构如下图所示。下列说法正确的是( ) A、1个X含有2个手性碳原子 B、X中存在4种含氧官能团 C、1molX最多能与2molNaOH发生反应 D、1分子X中含有3个sp3杂化的C原子5. 2021年9月,中国科学院天津工业生物技术研究所在实验室首次颠覆性地实现了从二氧化碳到淀粉分子的全合成,这是中国科学家在人工合成淀粉方面取得的原创性突破。下列有关说法中错误的是( )
A、1个X含有2个手性碳原子 B、X中存在4种含氧官能团 C、1molX最多能与2molNaOH发生反应 D、1分子X中含有3个sp3杂化的C原子5. 2021年9月,中国科学院天津工业生物技术研究所在实验室首次颠覆性地实现了从二氧化碳到淀粉分子的全合成,这是中国科学家在人工合成淀粉方面取得的原创性突破。下列有关说法中错误的是( ) A、反应①中二氧化碳被还原,氧化剂和还原剂的物质的量之比为3:1 B、该技术要得以推广,所需的大量氢气可以来自光伏电解X C、反应②涉及极性键与非极性键的断裂和生成 D、该技术的开发实现了无机物向有机物的转化,对缓解粮食危机具有重大意义6. 短周期主族非金属元素X、Y、Z、M的原子序数依次增大,其中Y与Z同族,Z原子最外层电子数等于X原子的核外电子总数,X与M、Y与Z的核电荷数之和均为22。下列说法正确的是( )A、将少量Na2CO3固体加入到X的最高价含氧酸的水溶液中,有气泡产生 B、X、Z分别与M形成的二元化合物中,各原子均满足8e-稳定结构 C、常温下,单质M能够从Y的简单氢化物中置换出单质Y D、X与Y形成的二元化合物为分子晶体,熔沸点低7. 南京大学科研团队首次发现氨还原过程中的多米诺效应:即一旦完成第①步,将自发完成后续步骤,反应过程示意图如下。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A、反应①中二氧化碳被还原,氧化剂和还原剂的物质的量之比为3:1 B、该技术要得以推广,所需的大量氢气可以来自光伏电解X C、反应②涉及极性键与非极性键的断裂和生成 D、该技术的开发实现了无机物向有机物的转化,对缓解粮食危机具有重大意义6. 短周期主族非金属元素X、Y、Z、M的原子序数依次增大,其中Y与Z同族,Z原子最外层电子数等于X原子的核外电子总数,X与M、Y与Z的核电荷数之和均为22。下列说法正确的是( )A、将少量Na2CO3固体加入到X的最高价含氧酸的水溶液中,有气泡产生 B、X、Z分别与M形成的二元化合物中,各原子均满足8e-稳定结构 C、常温下,单质M能够从Y的简单氢化物中置换出单质Y D、X与Y形成的二元化合物为分子晶体,熔沸点低7. 南京大学科研团队首次发现氨还原过程中的多米诺效应:即一旦完成第①步,将自发完成后续步骤,反应过程示意图如下。NA表示阿伏加德罗常数的值,下列说法正确的是( ) A、含有NA个价电子 B、中含有3NA个共价键 C、若参与第②步反应转移电子数为0.1NA D、①②③步反应均为氧化还原反应8. 超酸HSbF6是石油重整中常用的催化剂,实验室常以SbCl3、Cl2和HF为原料通过反应SbCl3+Cl2=SbCl5、SbCl5+6HF=HSbF6+5HCl制备。制备SbCl5的实验装置如图所示。已知:SbCl3的熔点73.4℃,沸点220.3℃,易水解;SbCl5的熔点3.5℃,液态SbCl5在140℃时即发生分解,2.9kPa下沸点为79℃,也易水解。下列说法错误的是( )
A、含有NA个价电子 B、中含有3NA个共价键 C、若参与第②步反应转移电子数为0.1NA D、①②③步反应均为氧化还原反应8. 超酸HSbF6是石油重整中常用的催化剂,实验室常以SbCl3、Cl2和HF为原料通过反应SbCl3+Cl2=SbCl5、SbCl5+6HF=HSbF6+5HCl制备。制备SbCl5的实验装置如图所示。已知:SbCl3的熔点73.4℃,沸点220.3℃,易水解;SbCl5的熔点3.5℃,液态SbCl5在140℃时即发生分解,2.9kPa下沸点为79℃,也易水解。下列说法错误的是( ) A、装置I中的a为冷凝水的进水口 B、装置II的主要作用是吸收Cl2和空气中的水蒸气 C、SbCl5制备完成后,可直接常压蒸馏分离出SbCl5 D、由SbCl5制备HSbF6时,不能选用玻璃仪器9. 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,错误的是( )
A、装置I中的a为冷凝水的进水口 B、装置II的主要作用是吸收Cl2和空气中的水蒸气 C、SbCl5制备完成后,可直接常压蒸馏分离出SbCl5 D、由SbCl5制备HSbF6时,不能选用玻璃仪器9. 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,错误的是( ) A、氧化性的强弱顺序为:Cl2>IO3->I2 B、途径Ⅱ中若生成1mol I2 , 消耗4mol NaHSO3 C、一定条件下,I-与IO3-反应可能生成I2 D、向含I-的溶液中通入Cl2 , 所得溶液加入淀粉溶液不一定变为蓝色10. 以铝土矿粉(主要含Al2O3、Fe2O3、SiO2 , 少量FeS2和金属硫酸盐);为原料生产Al2O3和Fe3O4的部分流程如下:
A、氧化性的强弱顺序为:Cl2>IO3->I2 B、途径Ⅱ中若生成1mol I2 , 消耗4mol NaHSO3 C、一定条件下,I-与IO3-反应可能生成I2 D、向含I-的溶液中通入Cl2 , 所得溶液加入淀粉溶液不一定变为蓝色10. 以铝土矿粉(主要含Al2O3、Fe2O3、SiO2 , 少量FeS2和金属硫酸盐);为原料生产Al2O3和Fe3O4的部分流程如下:
下列说法正确的是( )
A、“焙烧I”时,加入少量CaO可提高矿粉中硫的去除率 B、用NaOH溶液吸收过量SO2的离子方程式为: 2OH- +SO2=SO +H2O C、滤液中通入足量CO2 , 过滤后可得到Al2O3 D、无氧条件下进行“焙烧II”时,理论上消耗的n(FeS2):n(Fe2O3)=1:1611. 双极膜电渗析法固碳技术是将捕集的CO2转化为CaCO3而矿化封存,其工作原理如图所示。双极膜中间层中的H2O解离成H+和OH- , 并在直流电场作用下分别向两极迁移。下列说法错误的是( ) A、两个双极膜中间层中的H+均向左侧迁移 B、若碱室中比值增大,则有利于CO2的矿化封存 C、电解一段时间后,酸室中盐酸的浓度增大 D、该技术中电解固碳总反应的离子方程式为:2Ca2++2CO2+4H2O2CaCO3↓+2H2↑+O2↑+4H+12. 湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl)=]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是( )
A、两个双极膜中间层中的H+均向左侧迁移 B、若碱室中比值增大,则有利于CO2的矿化封存 C、电解一段时间后,酸室中盐酸的浓度增大 D、该技术中电解固碳总反应的离子方程式为:2Ca2++2CO2+4H2O2CaCO3↓+2H2↑+O2↑+4H+12. 湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl)=]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是( ) A、AgCl溶解度随c(Cl-)增大而不断减小 B、沉淀最彻底时,溶液中c(Ag+)=10-7.21mol•L-1 C、当c(Cl-)=10-2mol•L-1时,溶液中c(AgCl)>c(Ag+)>c(AgCl) D、25℃时,AgCl+Cl-AgCl的平衡常数K=100.2
A、AgCl溶解度随c(Cl-)增大而不断减小 B、沉淀最彻底时,溶液中c(Ag+)=10-7.21mol•L-1 C、当c(Cl-)=10-2mol•L-1时,溶液中c(AgCl)>c(Ag+)>c(AgCl) D、25℃时,AgCl+Cl-AgCl的平衡常数K=100.2二、多选题
-
13. 根据下列实验操作和现象所得到的实验结论正确的是( )
选项
实验操作和现象
实验结论
A
将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色
而该废铁屑中不含Fe(III)
B
向Na2SO3溶液中先加入少量Ba(NO3)2溶液,生成白色沉淀,过滤、洗涤,然后再向沉淀中加入稀盐酸,沉淀不溶解
Na2SO3溶液已经变质
C
向CuSO4溶液中加入KI溶液,再加入苯,振荡,上层呈紫红色,下层有白色沉淀生成
Cu2+可以氧化I- , 白色沉淀可能为CuI
D
向盛有Ag2O固体的两支试管中分别加入稀硝酸和氨水,Ag2O均溶解
Ag2O是两性氧化物
A、A B、B C、C D、D14. 某FexNy的晶胞如图1所示,晶胞边长为apm,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。下列说法正确的是( ) A、该FexNy的化学式为Fe2N B、与N等距且最近的N为8个 C、两个a位置Fe的最近距离为apm D、其中较稳定的Cu替代型产物的化学式为Fe3CuN15. 伯醇(记为)和叔醇(记为R3COH)发生酯化反应的机理如图所示。下列说法错误的是( )
A、该FexNy的化学式为Fe2N B、与N等距且最近的N为8个 C、两个a位置Fe的最近距离为apm D、其中较稳定的Cu替代型产物的化学式为Fe3CuN15. 伯醇(记为)和叔醇(记为R3COH)发生酯化反应的机理如图所示。下列说法错误的是( ) A、两种酯化反应生成H2O中的*OH均来源于羧酸 B、两个历程中H+均作催化剂 C、两个历程中碳的成键数目均保持不变 D、两种酯化反应的总反应均属于取代反应
A、两种酯化反应生成H2O中的*OH均来源于羧酸 B、两个历程中H+均作催化剂 C、两个历程中碳的成键数目均保持不变 D、两种酯化反应的总反应均属于取代反应三、非选择题
-
16. 碱土金属(IIA族)元素单质及其相关化合物的性质、合成一直以来是化学界研究的重点。回答下列问题:(1)、对于碱土金属元素Be、Mg、Ca、Sr、Ba,随着原子序数的增加,以下性质呈单调递减变化的是____。A、原子半径 B、单质的硬度 C、第一电离能(2)、(NH4)2BeF4是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为 , 阴离子中心原子杂化方式为。(3)、Sr是人体必需的微量元素,SrCO3是其重要的化合物之一。Sr2+的电子排布式为。判断SrCO3的热分解温度(填“大于”、“小于”)CaCO3的热分解温度,理由是。(4)、MgH2和金属Ni在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的储氢化合物,其立方晶胞结构如图所示:

①Mg原子周围距离最近且相等的Ni原子有个,若晶胞边长为646pm,则Mg—Ni核间距为pm(结果保留小数点后两位,取1.73)。
②若以晶胞中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则该化合物的储氢能力为(列出计算式即可。假定该化合物中所有的H可以全部放出,液氢密度为dg•cm-3;设NA代表阿伏加德罗常数的值)。
17. 是锂离子电池的活性材料。某小组以含锰矿料(主要成分是 , 含少量、、FeO、CoO和)为原料制备的流程如图所示(部分条件和产物省略)。
已知几种金属氢氧化物沉淀的pH如表所示:
金属氢氧化物
开始沉淀的pH
2.7
7.6
7.6
7.7
完全沉淀的pH
3.7
9.1
9.1
9.2
请回答下列问题:
(1)、写出一条提高“酸浸”速率的措施:。(2)、“除杂1”时,加入的作用是(用离子方程式表示)。(3)、“固体1”中除了含有外,还只含有另外一种固体,其化学式为 , 则“除杂1”过程调节pH范围为。(4)、在高温下“合成” , 反应的化学方程式为。(5)、已知:常温下,。为了使残液中 , 必须控制≥mol/L。(6)、“浸渣”中含少量锰元素,其测定方法如下:第1步:称取W g“浸渣”,加酸将锰元素以形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
第2步:取25.00mL上述定容后的溶液于锥形瓶中,加入少量催化剂和过量溶液,加热,充分反应后,煮沸溶液;
第3步:用溶液滴定至终点,消耗滴定液V mL,使重新变为。
已知:具有强氧化性,受热易分解。
①“浸渣”中锰元素的质量分数为(用含W、V的代数式表示)。
②如果省略第2步“煮沸溶液”,测得结果将(填“偏高”、“偏低”或“无影响”)。
18. 某课外小组探究含Cu2+的盐与Na2S2O3溶液的反应。查阅资料:
i.2+Cu2+[Cu(S2O3)2]2-(绿色),2+Cu+[Cu(S2O3)2]3-(无色);
ii.相比较 , Cu+更易与NH3络合为[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+(蓝色);
iii. 易被氧化为。
提出假设:
假设1:Cu2+与在溶液中发生络合反应生成[Cu(S2O3)2]2-;
假设2:Cu2+与在溶液中发生氧化还原反应。
实验探究一:探究CuSO4与Na2S2O3溶液的反应。
实验操作
序号
V1/mL
V2/mL
逐滴加入Na2S2O3溶液时的实验现象
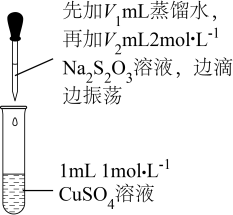
a
1.5
0.5
溶液逐渐变为绿色,静置无变化
b
1.0
1.0
溶液先变为绿色,后逐渐变成浅绿色,静置无变化
c
0
x
溶液先变为绿色,后逐渐变浅至无色,静置无变化
(1)、假设2的推测是因为Cu2+具有性。实验c中x=。(2)、根据实验a的现象可推测溶液中生成的含Cu微粒为(填化学符号)。(3)、某同学认为上述实验探究一可证明假设2成立,判断理由为。实验探究二:探究CuCl2与Na2S2O3溶液的反应。
 (4)、经检验白色沉淀为CuCl,从化学平衡的角度解释继续加Na2S2O3溶液后CuCl沉淀溶解的原因:。(5)、设计实验证明上述无色溶液中存在Cu+:。(6)、经检验氧化产物以形式存在。写出Cu2+与发生氧化还原反应得到无色溶液的离子方程式:。(7)、综合上述实验,可得出假设成立,试分析随着n():n(Cu2+)变化时,反应的趋势为。19. 化合物H是合成雌酮激素的中间体,科学家采用如图合成路线合成化合物H:
(4)、经检验白色沉淀为CuCl,从化学平衡的角度解释继续加Na2S2O3溶液后CuCl沉淀溶解的原因:。(5)、设计实验证明上述无色溶液中存在Cu+:。(6)、经检验氧化产物以形式存在。写出Cu2+与发生氧化还原反应得到无色溶液的离子方程式:。(7)、综合上述实验,可得出假设成立,试分析随着n():n(Cu2+)变化时,反应的趋势为。19. 化合物H是合成雌酮激素的中间体,科学家采用如图合成路线合成化合物H:
回答下列问题:
(1)、C中官能团的名称为。F的结构简式为 , 可用于鉴别E和F的试剂为。(2)、B生成C的化学方程式为。(3)、H分子和H2在一定条件下充分反应,所得产物中含有手性碳原子的个数为个。(4)、E的同分异构体中符合下列条件的有种,其中核磁共振氢谱有5组峰,且峰面积之比为6∶2∶2∶1∶1的结构简式为。①能发生银镜反应
②苯环上有三个取代基且其中两个为酚羟基
(5)、写出以苯和 为原料制备化合物
为原料制备化合物 的合成路线(参照以上合成路线,其他试剂任选)。 20. 热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题:(1)、碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O3H++HSO4- +2I- 、I-+I2 I3-。若起始时n(I2)=n(SO2)=1mol,I- 、I3- 、H+ 、HSO4-的物质的量随()的变化如图所示:
的合成路线(参照以上合成路线,其他试剂任选)。 20. 热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题:(1)、碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O3H++HSO4- +2I- 、I-+I2 I3-。若起始时n(I2)=n(SO2)=1mol,I- 、I3- 、H+ 、HSO4-的物质的量随()的变化如图所示:
图中表示的微粒:a为 , d为。
(2)、起始时 HI的物质的量为1mol,总压强为0.1MPa下,发生反应 HI(g) H2(g)+I2(g) 平衡时各物质的物质的量随温度变化如图所示:
①该反应的△H (“>”或“<”)0。
②600℃时,平衡分压p(I2)= MPa,反应的平衡常数Kp= (Kp为以分压表示的平衡常数)。
(3)、反应 H2(g)+I2(g) 2HI(g)的反应机理如下:第一步:I22I(快速平衡)
第二步:I+H2H2I(快速平衡)
第三步:H2I+I 2HI (慢反应)
①第一步反应 (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)•cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= (用含k1、k-1、k2…的代数式表示)。