山东省济南市2022届高三下学期5月模拟考试(三模)化学试题
试卷更新日期:2022-06-09 类型:高考模拟
一、单选题
-
1. 绿水青山就是金山银山。下列做法与该理念不相符的是( )A、使用可降解塑料 B、电镀废液经中和后直接排放 C、工业燃煤进行脱硫处理 D、利用微生物降解水域中的有毒有害物质2. 下列说法正确的是( )A、蒸馏粗溴苯时,温度计的水银球应置于蒸馏烧瓶的支管口处 B、用托盘天平称量4.0gNaOH时,先在左右两盘分别放质量相同的称量纸再称量 C、可用重结晶法除去苯甲酸固体中混有的NaCl,因为苯甲酸在水中的溶解度很大 D、向CH2=CH-CH2-CHO中滴加酸性高锰酸钾溶液,若紫色退去,则证明其分子中含有碳碳双键3. 下列关于化学本质或实质的说法中正确的是( )A、共价键的本质是原子轨道的重叠 B、胶体和溶液的本质区别是有无丁达尔效应 C、放热反应的实质为形成新化学键释放的能量小于破坏旧化学键吸收的能量 D、稀硫酸与Ba(OH)2溶液反应的实质为Ba2+ +OH- +H++=BaSO4 ↓+ H2O4. 一种由短周期主族元素组成的新型电池离子导体的结构如图所示,X、Y、Z原子序数依次增大,三者的核外电子数之和等于35,Y与Z位于同一周期。下列说法正确的是( )
 A、简单离子的半径:Y>X B、工业上常采用电解Y的氧化物冶炼单质Y C、同主族元素形成的简单氢化物中X的稳定性最强 D、同周期主族元素中第一电离能大于Z的元素有2种5. 下列有机物的系统命名正确的是( )A、3,4-甲基苯酚 B、2-甲基-1,3-二戊醇 C、2-乙基-1-丁烯 D、2,5-二甲基-4-乙基己烷6. 下列操作正确的是( )A、过滤沉淀时,用玻璃棒搅拌可加快过滤速率 B、可采用蒸发浓缩冷却结晶的方法从溶液中获取[Cu(NH3)4]SO4·H2O C、滴定终点时,发现盛标准液的滴定管尖嘴部分有悬滴,则所测待测液物质的量浓度偏大 D、用标准H2SO4溶液滴定待测NaOH溶液时,需量取25.00mLNaOH溶液于润洗过的锥形瓶中7. 下列有关物质性质与应用之间具有对应关系的有几种?( )
A、简单离子的半径:Y>X B、工业上常采用电解Y的氧化物冶炼单质Y C、同主族元素形成的简单氢化物中X的稳定性最强 D、同周期主族元素中第一电离能大于Z的元素有2种5. 下列有机物的系统命名正确的是( )A、3,4-甲基苯酚 B、2-甲基-1,3-二戊醇 C、2-乙基-1-丁烯 D、2,5-二甲基-4-乙基己烷6. 下列操作正确的是( )A、过滤沉淀时,用玻璃棒搅拌可加快过滤速率 B、可采用蒸发浓缩冷却结晶的方法从溶液中获取[Cu(NH3)4]SO4·H2O C、滴定终点时,发现盛标准液的滴定管尖嘴部分有悬滴,则所测待测液物质的量浓度偏大 D、用标准H2SO4溶液滴定待测NaOH溶液时,需量取25.00mLNaOH溶液于润洗过的锥形瓶中7. 下列有关物质性质与应用之间具有对应关系的有几种?( )①氯化铁溶液具有酸性,可用作刻蚀铜电路板
②二氧化氯具有强氧化性,可用作饮用水消毒
③氧化钙具有很强的吸水性,可用作食品干燥剂
④石英坩埚耐高温,可用来加热熔化烧碱纯碱等固体
⑤活性炭具有极强的吸附能力,可用作制糖业的脱色剂
⑥铜的金属活泼性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀
A、2 B、3 C、4 D、58. 工业上以铬铁矿( FeCr2O4 , 含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7·2H2O)的工艺流程如下,已知焙烧的目的是将FeCr2O4转化为Na2CrO4 , 并将Al、Si氧化物转化为可溶性钠盐。下列说法错误的是( ) A、可代替纯碱的化学试剂有烧碱、小苏打 B、中和后所得滤渣主要成分是Al(OH)3、Fe(OH)3 C、在上述流程中得到副产品Na2SO4时需趁热过滤 D、母液最适宜返回酸化步骤循环利用9. ZSM、[Zn(N2H4)2(N3)2]n等锌的配合物用途非常广泛,ZSM是2-甲基咪唑(
A、可代替纯碱的化学试剂有烧碱、小苏打 B、中和后所得滤渣主要成分是Al(OH)3、Fe(OH)3 C、在上述流程中得到副产品Na2SO4时需趁热过滤 D、母液最适宜返回酸化步骤循环利用9. ZSM、[Zn(N2H4)2(N3)2]n等锌的配合物用途非常广泛,ZSM是2-甲基咪唑( )和水杨酸(
)和水杨酸( )与锌形成的配合物。下列说法错误的是( ) A、空间构型为直线形 B、2-甲基咪唑分子中共平面的原子最多有8个 C、水中的溶解度:水杨酸小于对羟基苯甲酸 D、[Zn(N2H4)2(N3)2]n有两种配体,Zn2+的配位数是610. 玻璃仪器内璧残留的硫单质可用热NaOH溶液洗涤除去,发生如下反应:
)与锌形成的配合物。下列说法错误的是( ) A、空间构型为直线形 B、2-甲基咪唑分子中共平面的原子最多有8个 C、水中的溶解度:水杨酸小于对羟基苯甲酸 D、[Zn(N2H4)2(N3)2]n有两种配体,Zn2+的配位数是610. 玻璃仪器内璧残留的硫单质可用热NaOH溶液洗涤除去,发生如下反应:①3S+ 6NaOH2Na2S+ Na2SO3+ 3H2O
②(x-1)S+Na2SNa2Sx (x=2~6)
③S+ Na2SO3Na2S2O3
下列说法正确的是( )
A、反应①②③中,硫单质的作用相同 B、反应①中,每消耗1 mol硫单质转移4 mol电子 C、0.96g硫单质与amL2mol·L-1热NaOH溶液恰好完全反应,只生成Na2S和Na2SO3 , 则a= 60 D、1.28 g硫单质与10 mL 2 mol·L-1热NaOH溶液恰好完全反应,只生成Na2Sx和Na2S2O3 , 则x=511. 加氢甲酰化反应是加氢和甲酰基(-CHO)到1-烯烃的端基双键上,生成比原烯烃多一个C原子的醛的反应,是工业上获取直链醛和醇的重要反应。以RhH(CO)(PPh3)作催化剂的循环催化机理如图所示。已知,R为烃基,Ph为苯基,Rh为金属元素铑。下列说法错误的是( )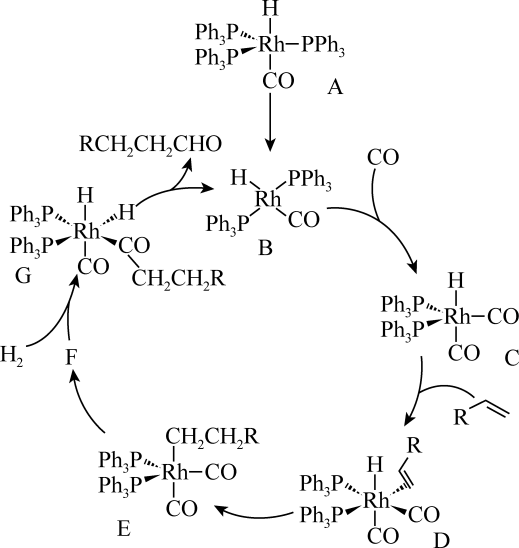 A、该循环催化中Rh的化合价发生了变化 B、化合物G与D中Rh的杂化方式相同 C、该过程的总反应为RCH=CH2+CO+H2→RCH2CH2CHO D、转化过程中的配位键都是由孤电子对与Rh形成的12. 室温下,向20mL0.1mol·L-1的HA(Ka=1.0×10-5)溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图中曲线①所示。下列说法错误的是( )
A、该循环催化中Rh的化合价发生了变化 B、化合物G与D中Rh的杂化方式相同 C、该过程的总反应为RCH=CH2+CO+H2→RCH2CH2CHO D、转化过程中的配位键都是由孤电子对与Rh形成的12. 室温下,向20mL0.1mol·L-1的HA(Ka=1.0×10-5)溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图中曲线①所示。下列说法错误的是( ) A、a点,pH>5 B、水的电离程度:c>b>a C、该滴定实验可选择酚酞做指示剂 D、若将HA改为20mL0.1mol·L-1的盐酸,则滴定曲线应如②所示
A、a点,pH>5 B、水的电离程度:c>b>a C、该滴定实验可选择酚酞做指示剂 D、若将HA改为20mL0.1mol·L-1的盐酸,则滴定曲线应如②所示二、多选题
-
13. 下列实验设计可以达到目的是( )
实验目的
实验设计
A
探究浓度对化学反应速率的影响
其他条件相同时,记录等浓度稀硫酸与不同浓度硫代硫酸钠溶液反应生成淡黄色沉淀的时间
B
证明Fe3+和I-之间的反应是可逆的
Fe3+与少量I-充分反应后,滴加KSCN溶液,若溶液变红色,则证明Fe3+和I-之间的反应是可逆的
C
探究钠能否置换出醇羟基中的氢
将一小块钠放入无水乙醇中,观察是否有气泡产生,若有,则说明钠能置换出醇羟基中的氢
D
制取并纯化氢气
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸
A、A B、B C、C D、D14. 柔红霉素的配基柔红酮(B)合成的最后一步如下:
下列说法错误的是( )
A、A、B两种物质都只有一个不对称碳原子 B、A、B两种物质的所有碳原子均可共平面 C、A、B两种物质均可被酸性重铬酸钾氧化 D、由物质A生成物质B的反应类型为氧化反应15. 现有一种安全、高效的双极制氢系统,该系统能够从阳极低电压醛氧化和阴极析氢反应中得到氢气;其工作原理如图所示。下列说法正确的是( ) A、电压越高,阳极制氢速率越快 B、电解一段时间后,阴极室的pH不变 C、制得1mol氢气,理论上有1molOH-透过交换膜 D、阳极反应为2R-CHO+4OH--2e-=2R-COO-+H2↑+2H2O
A、电压越高,阳极制氢速率越快 B、电解一段时间后,阴极室的pH不变 C、制得1mol氢气,理论上有1molOH-透过交换膜 D、阳极反应为2R-CHO+4OH--2e-=2R-COO-+H2↑+2H2O三、实验题
-
16. 苯甲酸乙酯(M=150g·mol-1)可用于配制香水香精和人造精油。本实验利用苯甲酸制备苯甲酸乙酯,实验中采用加入环己烷的方法,使环己烷、乙醇和水形成三元共沸物,沸点为62.1℃,反应装置和相关数据如下,加热和固定装置省略。回答下列问题:

试剂
密度/g·mL-1
沸点/℃
乙醇
0.7893
78.5
苯甲酸
1.2659
249
环己烷
0.7785
80
乙醚
0.7318
34.51
苯甲酸乙酯
1.05
211~213
(1)、本实验的反应原理为(用化学用语表示)。(2)、打开仪器A下端玻璃旋塞,放出的主要物质为 , 使用仪器A的目的为。(3)、当仪器A中(填现象),则可以停止加热。将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入饱和Na2CO3溶液至溶液呈中性,加入饱和Na2CO3溶液的作用是 , 再用(填仪器名称)进行分离。并用乙醚萃取水层中溶有的少量有机产品,将醚层与粗产品合并;用蒸馏水洗涤有机层2次,将醚层与水尽量分净,醚层从上口倒入一个干燥的锥形瓶中。(4)、加入MgSO4进行干燥,摇动锥形瓶,至醚层澄清透明;过滤后将醚层加入到干燥的蒸馏烧瓶中,粗产物进行减压蒸馏(装置如图所示)。毛细管的作用是(写出一条即可)。 (5)、若实验中加入苯甲酸8.0g(M=122g·mol-1),收集到苯甲酸乙酯6.0mL,则本实验的产率为%(保留两位有效数字)。
(5)、若实验中加入苯甲酸8.0g(M=122g·mol-1),收集到苯甲酸乙酯6.0mL,则本实验的产率为%(保留两位有效数字)。四、结构与性质
-
17. 最近合成的一种铁基超导材料CaxFeyAsz(相对分子质量为M),在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
 (1)、基态As原子价电子排布式为。(2)、As、Fe、Ca电负性由大到小的顺序为。FeCl3的沸点(319℃)高于AsCl3的沸点(130.2℃),原因是。(3)、该材料的化学式为 , 已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为apm、apm、cpm,晶胞中As原子1和As原子2的分数坐标分别为、。(4)、设阿伏加德罗常数为NA , 则该晶体的密度为g·cm-3(用含M的代数式表示)。
(1)、基态As原子价电子排布式为。(2)、As、Fe、Ca电负性由大到小的顺序为。FeCl3的沸点(319℃)高于AsCl3的沸点(130.2℃),原因是。(3)、该材料的化学式为 , 已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为apm、apm、cpm,晶胞中As原子1和As原子2的分数坐标分别为、。(4)、设阿伏加德罗常数为NA , 则该晶体的密度为g·cm-3(用含M的代数式表示)。五、工业流程题
-
18. 碱式氧化镍(NiOOH)是镍氢电池的正极材料,工业上可由铜冶炼过程中产生的粗硫酸镍废液(含有Cu2+、Fe2+、Al3+、Ca2+、H3AsO3等杂质微粒)为原料制备,某兴趣小组模拟该制备过程并设计如下流程:

已知:Ksp(FeAsO4)=5.7×10-21 , H3AsO3的还原性比Fe2+强。
回答下列问题:
(1)、“萃取”时需充分振荡,目的是。(2)、“氧化1”中H2O2的作用是 , 若该废液中H3AsO3和Fe2+的浓度分别是0.02 mol·L-1和0.12 mol·L-1 , 除去砷后的废液中c()=mol·L-1(不考虑反应过程中溶液体积的微小变化)(3)、“沉钙”时,若溶液酸度过高,Ca2+沉淀不完全,原因是。(4)、“氧化2”反应的离子方程式为。(5)、“洗涤”时,检验产品是否洗涤干净的方法是。(6)、已知某镍氢电池的离子导体为KOH溶液,电池反应为MH+NiOOHM+Ni(OH)2 , 则放电时,OH-移向电极(填“MH”或“NiOOH”),充电时NiOOH电极上的电极反应式为。六、有机推断题
-
19. AigialomycinD是从海生红树林菌类中分离出来的一种具有重要生理活性的物质,具有极强的抗癌活性和抗疟疾活性。一种合成路线为:

已知:①已知,Et为乙基,Ph为苯基
②

回答下列问题:
(1)、AigialomycinD中含氧官能团的名称是 , C分子的核磁共振氢谱中有组峰。(2)、C→D的化学方程式为 , D→E的反应类型为。(3)、F的分子式为。(4)、符合下列条件的D的同分异构体有种①含有苯环且有四个羟基与苯环直接相连
②苯环上无氢原子
(5)、官能团的保护是有机合成中的重要步骤,写出制备AigialomycinD中引入保护基的步骤(例如X→Y)(6)、写出以 为原料制备
为原料制备 的合成路线(其他试剂任选,注明反应条件)。
的合成路线(其他试剂任选,注明反应条件)。 七、原理综合题
-
20. 氨气是一种非常重要的化工原料,研究其相关反应极具意义。回答下列问题:(1)、一定条件下,向VL的恒容密闭容器中通入4molNH3和5molO2发生下列反应:
I.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH1
II.2NH3(g) +2O2(g) N2O(g)+3H2O(g) ΔH2
III.4NO(g) 2N2O(g)+O2(g) ΔH3
①ΔH1、ΔH2、ΔH3之间的关系式为ΔH3=。
②达到平衡时,容器中含有a mol NO和b mol N2O,此时H2O(g)的浓度为mol·L-1。(用含a、b、V的代数式表示,下同),该温度下反应III的平衡常数为L·mol-1。
(2)、一定条件下,将0.1molNH3通入3L的密闭容器中进行反应2NH3(g) N2(g)+3H2(g)(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容积不变,t1时反应达到平衡,用N2的浓度变化表示0~t1时间内的反应速率v(N2)=mol· L-1·min-1(用含t1的代数式表示);
②若t2时将容积迅速增大至原来的2倍并保持不变,则图中能符合题意表示容积增大后H2分压变化趋势的曲线是(用a、b、c、d表示),理由是。
③若t2时保持容积不变再充入0.1 mol NH3 , 则化学平衡将(填“正向移动”“逆向移动”或“不移动”),再次达到平衡时,与t1时相比,NH3的体积分数(填“变大”“变小”或“不变”)
-
-
-
-