辽宁省大连市2021-2022学年高三第二次模拟考试化学试题
试卷更新日期:2022-06-09 类型:高考模拟
一、单选题
-
1. 化学与科学、技术及生活有着密切联系.下列叙述错误的是( )A、神舟十三号返回舱使用了酚醛空心微球,酚醛树脂属于通用高分子材料 B、液氧煤油发动机应用于我国新一代长征七号运载火箭中,煤油由煤干馏得到 C、核酸检测用于确定人体是否被新冠病毒感染,核酸属于生物大分子 D、北京冬奥会颁奖礼服添加了石墨烯发热材料,石墨烯属于新型无机非金属材料2. 下列化学用语表达正确的是( )A、氧的基态原子的轨道表示式:
 B、的电子式:
B、的电子式: C、对羟基苯甲醛的结构简式:
C、对羟基苯甲醛的结构简式: D、丙炔的键线式:
D、丙炔的键线式: 3. 宋应星著作的《天工开物》被称为中国十七世纪生产工艺百科全书,它翔实记述了明代居于世界先进水平的科技成就.下列说法错误的是( )
3. 宋应星著作的《天工开物》被称为中国十七世纪生产工艺百科全书,它翔实记述了明代居于世界先进水平的科技成就.下列说法错误的是( )选项
记载内容
涉及化学操作或物质分类
A
作咸卷海水盐篇记载:“火燃釜底,滚沸延及成盐”
采用蒸发结晶的方法获取食盐
B
甘嗜卷造糖篇记载:“每汁一石,下石灰()五合于中”
用石灰中和甘蔗汁中的酸性物质
C
治铸卷·钟篇记载:“内模干燥后,用牛油加黄蜡涂附在上面约有几寸厚”
牛油为天然高分子化合物
D
五金卷·铜篇记载:“以炉甘石或倭铅参和,转色为黄铜:以砒霜等药制炼为白铜:矾、硝等药制炼为青铜”
黄铜、白铜和青铜均为铜合金
A、A B、B C、C D、D4. 84消毒液不能和医用酒精混用的原因是。设为阿伏加德罗常数的值。下列说法正确的是( )A、溶液中数目为 B、中含有σ键数目为 C、标准状况下,中原子数为 D、室温下,为13的溶液中数目为5. 异烟肼是一种抗结核药物的主要成分,其结构如图所示。已知吡啶( )与苯的性质相似。下列说法错误的是( )
)与苯的性质相似。下列说法错误的是( ) A、该分子中氮原子均采取杂化 B、该分子中电负性最大的元素为氧元素 C、该分子与水分子可以形成氢键 D、该分子中所有碳原子一定共平面6. 研究表明木豆素对学习记忆障碍有一定的改善作用,木豆素的结构如图所示。下列有关木豆素的说法错误的是( )
A、该分子中氮原子均采取杂化 B、该分子中电负性最大的元素为氧元素 C、该分子与水分子可以形成氢键 D、该分子中所有碳原子一定共平面6. 研究表明木豆素对学习记忆障碍有一定的改善作用,木豆素的结构如图所示。下列有关木豆素的说法错误的是( )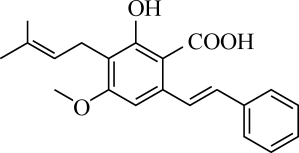 A、苯环上的一氯代物有4种 B、分子中含5种官能团 C、能与氯化铁溶液发生显色反应 D、该物质能发生取代、加成和加聚反应7. 电子科技大学孙旭平教授团队研究出一种磷化硼纳米颗粒作为高选择性电化学还原为甲醇的非金属电催化剂,磷化硼晶胞结构如图所示。下列说法正确的是( )
A、苯环上的一氯代物有4种 B、分子中含5种官能团 C、能与氯化铁溶液发生显色反应 D、该物质能发生取代、加成和加聚反应7. 电子科技大学孙旭平教授团队研究出一种磷化硼纳米颗粒作为高选择性电化学还原为甲醇的非金属电催化剂,磷化硼晶胞结构如图所示。下列说法正确的是( ) A、若氮化硼与磷化硼具有相似的结构,则BN的熔点比BP低 B、磷化硼晶体中“一般共价键”与配位键的数目之比为1∶3 C、磷化硼晶体中,每个磷原子周围紧邻且距离相等的硼原子共有2个 D、若A,D两处磷原子坐标分别为、 , 则E处硼原子坐标为8. 钛合金材料已经广泛应用于国防、航天、医疗等领域。已知常温下钛()与酸、碱均不反应,高温下能被空气氧化。由钛铁矿(主要成分为)提取金属钛的主要流程如图所示。下列有关叙述正确的是( )
A、若氮化硼与磷化硼具有相似的结构,则BN的熔点比BP低 B、磷化硼晶体中“一般共价键”与配位键的数目之比为1∶3 C、磷化硼晶体中,每个磷原子周围紧邻且距离相等的硼原子共有2个 D、若A,D两处磷原子坐标分别为、 , 则E处硼原子坐标为8. 钛合金材料已经广泛应用于国防、航天、医疗等领域。已知常温下钛()与酸、碱均不反应,高温下能被空气氧化。由钛铁矿(主要成分为)提取金属钛的主要流程如图所示。下列有关叙述正确的是( ) A、基态原子的价层电子排布式为 B、可用稀盐酸或稀氢氧化钠溶液除去金属钛中的少量镁单质 C、步骤Ⅱ中焦炭为还原剂,为还原产物 D、步骤Ⅲ需在氮气氛围中进行,防止金属被空气氧化9. 下列实验操作或做法不能达到目的的是( )
A、基态原子的价层电子排布式为 B、可用稀盐酸或稀氢氧化钠溶液除去金属钛中的少量镁单质 C、步骤Ⅱ中焦炭为还原剂,为还原产物 D、步骤Ⅲ需在氮气氛围中进行,防止金属被空气氧化9. 下列实验操作或做法不能达到目的的是( )选项
操作或做法
目的
A
将丙酮加入到适量碘水中,振荡,静置
萃取碘水中的
B
向盐碱地(含有较多、)中施加适量石膏
降低土壤的碱性
C
将两支盛有溶液的试管分别置于热水和冷水中
探究温度对化学平衡的影响
D
在薄钢板表面镀上一层锌
在金属表面覆盖保护层保护金属不被腐蚀
A、A B、B C、C D、D10. 锌-二氧化碳可充电电池作为一门新兴的技术,不仅可以缓解所带来的温室效应,同时还可获得增值化学品(如乙酸,乙醇等)和额外电能。如图所示装置中,双极膜中水电离出的和在电场作用下可以向两极迁移
下列说法正确的是( )
A、放电时,外电路中电流由流向纳米片 B、当外电路通过电子时,理论上双极膜中水减少18g C、放电时,双极膜中H+向Zn电极迁移 D、充电时,阳极上的电极反应式为11. 一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法错误的是( ) A、过程Ⅰ中,氧化产物与还原产物的物质的量之比为6∶5 B、的空间结构为正四面体形 C、过程Ⅰ、Ⅱ、Ⅲ中发生的均为氧化还原反应 D、流程中所涉及元素的基态原子未成对电子数最多的是P12. 苯的亲电取代反应分两步进行,可表示为E++
A、过程Ⅰ中,氧化产物与还原产物的物质的量之比为6∶5 B、的空间结构为正四面体形 C、过程Ⅰ、Ⅱ、Ⅲ中发生的均为氧化还原反应 D、流程中所涉及元素的基态原子未成对电子数最多的是P12. 苯的亲电取代反应分两步进行,可表示为E++
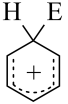
 +H+ , 生成中间体的一步是加成过程,中间体失去氢离子的一步是消除过程,其机理亦称加成—消除机理,苯的亲电职代反应进程和能量的关系如图,下列说法错误的是( )
+H+ , 生成中间体的一步是加成过程,中间体失去氢离子的一步是消除过程,其机理亦称加成—消除机理,苯的亲电职代反应进程和能量的关系如图,下列说法错误的是( ) A、反应Ⅰ为苯亲电取代的决速步骤 B、E1与E2的差值为总反应的焓变 C、中间体的能量比苯的高,稳定性比苯的差 D、反应过程中,环上碳原子的杂化类型发生了变化13. 某反应的速率方程为 , 其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为。改变反应物浓度时,反应的瞬时速率如表所示:
A、反应Ⅰ为苯亲电取代的决速步骤 B、E1与E2的差值为总反应的焓变 C、中间体的能量比苯的高,稳定性比苯的差 D、反应过程中,环上碳原子的杂化类型发生了变化13. 某反应的速率方程为 , 其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为。改变反应物浓度时,反应的瞬时速率如表所示:0.25
0.050
1.4
0.50
0.050
2.8
1.00
0.050
5.6
0.50
0.100
2.8
下列说法正确的是( )
A、速率方程中的、 B、该反应的速率常数 C、增大反应物浓度,k增大导致反应的瞬时速率加快 D、在过量的B存在时,反应掉87.5%的A所需的时间是375min14. 一种高效电解质的结构如图所示,W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X与Q同族,Y和Z的原子序数之和与Q相等。下列说法正确的是( ) A、X与Q的最高化合价均为+6 B、化合物QX2、YX2均能与NaOH溶液反应 C、简单氢化物的沸点:Q>Z>X D、W单质在空气中燃烧的产物是W2O215. 柠檬酸(用表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中、、、的百分含量随的变化曲线如图所示。下列说法中错误的是( )
A、X与Q的最高化合价均为+6 B、化合物QX2、YX2均能与NaOH溶液反应 C、简单氢化物的沸点:Q>Z>X D、W单质在空气中燃烧的产物是W2O215. 柠檬酸(用表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中、、、的百分含量随的变化曲线如图所示。下列说法中错误的是( ) A、的第二步电离常数约为 B、溶液中,水解程度小于电离程度 C、时, D、时,
A、的第二步电离常数约为 B、溶液中,水解程度小于电离程度 C、时, D、时,二、综合题
-
16. 钴蓝是一种重要的蓝色颜料。利用含钴废料(主要成分为 , 还含有少量的铝箔)制备钴蓝的一种工艺流程如图:

已知:
请回答以下问题:
(1)、Co元素位于元素周期表第周期第族(2)、写出“酸浸”步骤中发生反应的化学方程式;在实际生产中,“酸浸”不用盐酸的原因是(3)、已知钴、锂在有机磷萃取剂中的萃取率与pH的关系如图1所示,则有机磷萃取的最佳pH为 (4)、根据图2判断,“沉锂”步骤中获取的操作依次是、、洗涤、干燥
(4)、根据图2判断,“沉锂”步骤中获取的操作依次是、、洗涤、干燥 (5)、若溶液中 , 为防止沉钴过程中产生沉淀,需控制溶液的pH不高于(保留一位小数)(6)、写出灼烧过程中主要反应的化学方程式17. 我国提出2060年前实现碳中和,为有效降低大气CO2中的含量,以CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
(5)、若溶液中 , 为防止沉钴过程中产生沉淀,需控制溶液的pH不高于(保留一位小数)(6)、写出灼烧过程中主要反应的化学方程式17. 我国提出2060年前实现碳中和,为有效降低大气CO2中的含量,以CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:Ⅰ.主反应:
Ⅱ.副反应:
(1)、已知:Ⅲ.Ⅳ.
则
(2)、CO2加氢合成甲烷时,通常控制温度为左右,其可能的原因为____A、反应速率快 B、平衡转化率高 C、催化剂活性高 D、主反应催化剂选择性好(3)、时,向1L恒容密闭容器中充入和 , 初始压强为p,时主、副反应都达到平衡状态,测得 , 体系压强为 , 则内 , 平衡时选择性=(选择性 , 计算保留三位有效数字)(4)、以催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式(为活化能,k为速率常数,R和C为常数)。则该反应的活化能。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是。 18. 过碳酸钠俗称固体双氧水,是由碳酸钠、过氧化氢和水三组分体系利用氢键所形成的不稳定的复合物,高温下容易分解,易溶于水。可以替代过氧化钙作为水产养殖业的供氧剂,给在贮运过程中的鱼、虾等生物供氧保鲜,放氧速率高于过氧化钙。某实验小组模拟工业生产过碳酸钠,装置如图所示。
18. 过碳酸钠俗称固体双氧水,是由碳酸钠、过氧化氢和水三组分体系利用氢键所形成的不稳定的复合物,高温下容易分解,易溶于水。可以替代过氧化钙作为水产养殖业的供氧剂,给在贮运过程中的鱼、虾等生物供氧保鲜,放氧速率高于过氧化钙。某实验小组模拟工业生产过碳酸钠,装置如图所示。 (1)、装置中仪器A的名称为。(2)、按图连接好装置后,先将饱和溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是____。A、 B、 C、 D、(3)、反应过程中要控制温度不能太高,原因是(4)、反应后向混合物中加入固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入固体的作用是(5)、过碳酸钠样品纯度的测定。
(1)、装置中仪器A的名称为。(2)、按图连接好装置后,先将饱和溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是____。A、 B、 C、 D、(3)、反应过程中要控制温度不能太高,原因是(4)、反应后向混合物中加入固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入固体的作用是(5)、过碳酸钠样品纯度的测定。取配成溶液,取溶液于锥形瓶,加入足量稀硫酸,用溶液滴定至终点,消耗溶液(已知:)
①实验达到滴定终点的现象是;
②该过氧碳酸钠的产品纯度为(用字母表示);
③滴定时间过长,测得过碳酸钠产品纯度将(填“偏高”、“偏低”或“无影响”)。
19. 我国科学家实现了喹啉并内酯的高选择性制备。合成路线如图。
ⅰ. R-Br+R´CHO
ⅱ.ROH+ R´BrROR´
ⅲ.碳碳双键直接与羟基相连不稳定
(1)、试剂a为;C中含氧官能团名称为(2)、的酸性比(填“强”或“弱”);其原因是(3)、的化学方程式为(4)、H的结构简式为;的反应类型为(5)、K是F的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有种;其中存在手性碳原子的同分异构体的结构简式为