河南省郑州市2022届高三第三次质量预测理综化学试题
试卷更新日期:2022-06-09 类型:高考模拟
一、单选题
-
1. 长征五号系列运载火箭是我国首型大推力无毒、无污染液体燃料火箭,运载能力位居世界前列,是中国由航天大国迈向航天强国的显著标志和重要支撑。下列叙述错误的是( )A、火箭芯一级尾段使用的碳纤维材料属于新型无机非金属材料 B、火箭的整流罩前锥段材料-聚甲基丙烯酰亚胺属于有机高分子材料 C、火箭采用2219-铝合金做箭体的蒙皮材料,有利于减轻火箭的质量 D、火箭的推进剂是四氧化二氮和偏二甲肼2. 下图是在Cu基分子筛表面用NH3处理 NO,污染物的一种反应机理。下列说法正确的是( )

注:图中元素右上角的罗马数字表示化合价
A、该过程中化合价发生变化的只有N和O两种元素 B、上述过程中催化剂首先吸附的是NO C、该过程中氧化产物和还原产物只有N2 D、该过程的总反应为4NH3+4NO+O2N2+6H2O3. 海带中含有丰富的碘元素,某化学兴趣小组设计的海带提碘实验流程如下图,下列说法中正确的是( ) A、上述流程中各步操作用到的仪器包括:
A、上述流程中各步操作用到的仪器包括: 、
、 、
、 、
、 、
、 B、“氧化”时,试剂可选用O2、H2O2或Br2
C、上述流程包括三个氧化还原反应和三种分离操作
D、“反萃取”时,反应的离子方程式为I2+2OH-=I-+IO+H2O
4. 下图为某物质的结构。已知:W、Y、Z属于不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )
B、“氧化”时,试剂可选用O2、H2O2或Br2
C、上述流程包括三个氧化还原反应和三种分离操作
D、“反萃取”时,反应的离子方程式为I2+2OH-=I-+IO+H2O
4. 下图为某物质的结构。已知:W、Y、Z属于不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )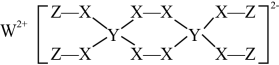 A、Y元素在周期表中的位置为第二周期IVA族 B、W、X对应的简单离子半径:X>W C、该物质具有强氧化性,可以用作漂白剂 D、该物质中,Y、X原子的最外层均满足8电子结构5. 有机物Q的合成路线如下图所示,相关说法错误的是( )
A、Y元素在周期表中的位置为第二周期IVA族 B、W、X对应的简单离子半径:X>W C、该物质具有强氧化性,可以用作漂白剂 D、该物质中,Y、X原子的最外层均满足8电子结构5. 有机物Q的合成路线如下图所示,相关说法错误的是( ) A、N可以直接合成高分子化合物 B、O生成P的反应类型为加成反应 C、P可以在Cu的催化作用下发生氧化反应 D、Q分子存在属于芳香族化合物的同分异构体6. 某微生物燃料电池以对氯苯酚(分子式:C6H5OCl,用RCl表示)和醋酸钠为原料,其工作原理如下图所示。下列说法错误的是( )
A、N可以直接合成高分子化合物 B、O生成P的反应类型为加成反应 C、P可以在Cu的催化作用下发生氧化反应 D、Q分子存在属于芳香族化合物的同分异构体6. 某微生物燃料电池以对氯苯酚(分子式:C6H5OCl,用RCl表示)和醋酸钠为原料,其工作原理如下图所示。下列说法错误的是( ) A、工作时H+通过质子交换膜向左侧电极迁移 B、左侧电极反应式为:C6H5OCl+2e-+H+=C6H5OH+Cl- C、反应中1molCH3COO-参与放电可生成8molH+ D、放电后体系的pH降低7. 某化学兴趣小组在学习完温度对盐类水解的影响后,测定了0.1mol·L-1Na2CO3溶液的pH随温度的变化,结果如下图所示。下列分析正确的是( )
A、工作时H+通过质子交换膜向左侧电极迁移 B、左侧电极反应式为:C6H5OCl+2e-+H+=C6H5OH+Cl- C、反应中1molCH3COO-参与放电可生成8molH+ D、放电后体系的pH降低7. 某化学兴趣小组在学习完温度对盐类水解的影响后,测定了0.1mol·L-1Na2CO3溶液的pH随温度的变化,结果如下图所示。下列分析正确的是( ) A、升温前溶液呈碱性的原因是:CO+2H2OH2CO3+2OH- B、常温下,0.1 mol·L-1Na2CO3溶液中:c(Na+)>2c(CO)+c(HCO) C、温度升高,Na2CO3水解程度增大,溶液pH增大,故图1实验数据一定不符合题意 D、降低温度,Na2CO3水解平衡移动和水的电离平衡移动对溶液pH的影响一致
A、升温前溶液呈碱性的原因是:CO+2H2OH2CO3+2OH- B、常温下,0.1 mol·L-1Na2CO3溶液中:c(Na+)>2c(CO)+c(HCO) C、温度升高,Na2CO3水解程度增大,溶液pH增大,故图1实验数据一定不符合题意 D、降低温度,Na2CO3水解平衡移动和水的电离平衡移动对溶液pH的影响一致二、综合题
-
8. 某同学查阅资料得知,在无水三氯化铝的催化作用下,利用乙醇制备乙烯的反应温度为120℃。反应装置如下图所示:

实验过程:检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝和10mL无水乙醇,点燃酒精灯加热。
请回答相关问题:
(1)、该催化机理如下所示,某同学判断该机理中一定有水生成,请写出生成H2O的步骤中反应方程式。 (2)、仪器B的名称为。该实验所采用的加热方式优点是。实验装置中还缺少的仪器是。(3)、B中无水氯化钙的作用是。甲同学认为可以将B装置改为装有浓硫酸的洗气瓶,老师否定了他的观点,理由是。(4)、气囊的作用是。其优点是。(5)、溴的四氯化碳溶液的作用是。(6)、中学教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有(任意写出两条即可)。9. 火法炼铜过程中产生的碱性渣,其主要成分为TeO2、Na2TeO3、Na2SeO3以及少量的CuO、PbO、SiO2等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。
(2)、仪器B的名称为。该实验所采用的加热方式优点是。实验装置中还缺少的仪器是。(3)、B中无水氯化钙的作用是。甲同学认为可以将B装置改为装有浓硫酸的洗气瓶,老师否定了他的观点,理由是。(4)、气囊的作用是。其优点是。(5)、溴的四氯化碳溶液的作用是。(6)、中学教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有(任意写出两条即可)。9. 火法炼铜过程中产生的碱性渣,其主要成分为TeO2、Na2TeO3、Na2SeO3以及少量的CuO、PbO、SiO2等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。
已知:Ksp (CuS)=6×10-36;Ksp(PbS)=9×10-29。
请回答以下问题:
(1)、“碱浸”前应对碱性渣进行的操作是。(2)、下图分别是温度和NaOH溶液浓度对碲浸出率的影响,则碱浸时的合适温度是。实际生产中采用1mol·L-1的NaOH溶液,而不用更大浓度 NaOH溶液的原因是。 (3)、已知:CuO和PbO均具有一定的“两性”,“碱浸”时生成物类型类似于偏铝酸钠。则“碱浸”时PbO所发生反应的离子方程式为。(4)、滤渣3的主要成分为。滤液中Pb2+沉淀完全时,c(Cu2+)的最大值是mol·L-1 , (保留小数点后2位。某离子浓度低于1×10-5mol·L-1时,可认为该离子沉淀完全)(5)、电解制碲时阴极的电极反应式为。电解余液经处理后可循环使用于步骤。电解时电流为10A,电解时间为4h。若生成碲(Te)的电流利用率为95%,则生成碲的质量为。(法拉第常数为96500C·mol-1 , 保留小数点后1位)10. 丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。回答下列问题:(1)、丙烷脱氢制备丙烯。由图可得C3H8(g)=C3H6(g)+H2(g) ΔH=kJ·mol-1。
(3)、已知:CuO和PbO均具有一定的“两性”,“碱浸”时生成物类型类似于偏铝酸钠。则“碱浸”时PbO所发生反应的离子方程式为。(4)、滤渣3的主要成分为。滤液中Pb2+沉淀完全时,c(Cu2+)的最大值是mol·L-1 , (保留小数点后2位。某离子浓度低于1×10-5mol·L-1时,可认为该离子沉淀完全)(5)、电解制碲时阴极的电极反应式为。电解余液经处理后可循环使用于步骤。电解时电流为10A,电解时间为4h。若生成碲(Te)的电流利用率为95%,则生成碲的质量为。(法拉第常数为96500C·mol-1 , 保留小数点后1位)10. 丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。回答下列问题:(1)、丙烷脱氢制备丙烯。由图可得C3H8(g)=C3H6(g)+H2(g) ΔH=kJ·mol-1。 (2)、将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应。经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如下图所示。c(H2)和c(C3H6)变化差异的原因为(用化学方程式表示)。
(2)、将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应。经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如下图所示。c(H2)和c(C3H6)变化差异的原因为(用化学方程式表示)。 (3)、已知Arrhenius 经验公式为Rlnk=RlnA-(Ea为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应在某条件下的Arrhenius 经验公式的实验数据如图中曲线a所示,其活化能为J·mol-1 , 当其实验数据发生变化如图中b线所示,则可能的原因是。
(3)、已知Arrhenius 经验公式为Rlnk=RlnA-(Ea为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应在某条件下的Arrhenius 经验公式的实验数据如图中曲线a所示,其活化能为J·mol-1 , 当其实验数据发生变化如图中b线所示,则可能的原因是。 (4)、工业上用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
(4)、工业上用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:①CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3 (g)
②CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3和Cl2发生反应,容器内气体的压强随时间的变化如下表所示。
时间/min
0
60
120
180
240
300
360
压强/kPa
80
74.2
69.2
65.2
61.6
58
58
该温度下,若平衡时HCl的体积分数为10%。此时CH2=CHCH3的转化率为。反应①的压力平衡常数Kp=kPa-1(保留小数点后2位)。
(5)、一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图所示。
保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是____。
A、适当提高反应温度 B、改变催化剂 C、适当降低反应温度 D、改变反应物浓度11. 2022年以来,全球化石能源价格一路飙升,对全球经济复苏产生巨大影响。氢能源是一种不依赖化石燃料的储量丰富的清洁能源。(1)、电解水产氢是目前较为理想的制氢技术,这项技术的广泛应用一直被高价的贵金属催化剂所制约。我国科学家开发了一种负载氧化镍纳米晶粒的聚合物氮化碳二维纳米材料,大幅提高了催化效率。①基态 Ni原子的价电子排布式为 , 该元素在元素周期表中的位置是。
②C、N、O的电负性的由大到小的顺序是。
③为寻找更多的金属催化剂,科学家从众多金属元素中选取Co、Fe、Cu进行了相关研究,并取得了成功。选取这三种金属进行相关研究的原因可能是。
(2)、开发新型储氢材料是氢能利用的重要研究方向。氨硼烷(NH3BH3)是一种潜在的储氢材料,可由(HB=NH)3(结构为平面六元环状)通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6NH3BH3。①请解释CH4、H2O、CO2的键角大小顺序。
②(HB=NH)3中B、N原子的杂化轨道类型分别为。
③氨硼烷(NH3BH3)中N、B都达到稳定结构,用化学键表示出(NH3BH3)分子的结构式。
(3)、有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进到由Cu原子与Ag原子构成的全部四面体空隙中。①该晶体储氢后的化学式为。
②储氢材料的储氢能力= , 若晶胞参数为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为bg·cm-3 , 则该储氢材料的储氢能力为。(NA表示阿伏加德罗常数,写出表达式即可)
12. 从猫薄荷植物中分离出来的荆芥内酯,可用来制取具有驱虫效能的二氢荆芥内酯。为研究二氢荆芥内酯的合成和性质,进行了如下反应。 (1)、物质B的名称是。(2)、C中官能团的结构式为。(3)、D中有3个甲基,则D的结构简式为。(4)、试剂1为 。(5)、A、F互为同分异构体,则E→F的化学方程式为。(6)、H是E的同系物,且比E少两个碳原子。满足下列条件的H的同分异构体有种(不考虑立体异构);其中被氧化后核磁共振氢谱有三组峰,面积比为1:1:4的有机物的结构简式为。
(1)、物质B的名称是。(2)、C中官能团的结构式为。(3)、D中有3个甲基,则D的结构简式为。(4)、试剂1为 。(5)、A、F互为同分异构体,则E→F的化学方程式为。(6)、H是E的同系物,且比E少两个碳原子。满足下列条件的H的同分异构体有种(不考虑立体异构);其中被氧化后核磁共振氢谱有三组峰,面积比为1:1:4的有机物的结构简式为。①有两个取代基的六元碳环;②1mol该同分异构体分别与足量的Na和NaHCO3反应生成气体物质的量相同。
(7)、F→G的反应类型是。该反应在非水溶剂中进行的原因是。