河南省洛阳市2022届高三第三次统一考试理科综合化学试题
试卷更新日期:2022-06-09 类型:高考模拟
一、单选题
-
1. 科技改变生活。下列说法正确的是( )A、丰宁抽水蓄能电站保障了北京冬奥会的电力供应,利用的是电能和化学能的相互转化 B、“雷霆之星”速滑服采用银离子抗菌技术,可有效防护细菌侵入 C、“天问一号”中Ti- Ni形状记忆合金的两种金属都属于主族金属元素 D、“天机芯”是全球首款异构融合类脑计算芯片,其主要成分和光导纤维相同2. 某天然有机物具有抗肿瘤等生物活性,其结构简式如下。下列关于该有机物的叙述错误的是( )
 A、分子式为C15H18O3 B、能使酸性高锰酸钾溶液褪色 C、能够发生水解反应 D、该有机物中所有碳原子可以共面3. 下列图示不能用于物质分离提纯操作的是( )A、
A、分子式为C15H18O3 B、能使酸性高锰酸钾溶液褪色 C、能够发生水解反应 D、该有机物中所有碳原子可以共面3. 下列图示不能用于物质分离提纯操作的是( )A、 B、
B、 C、
C、 D、
D、 4. 在催化剂作用下,乙基格氏试剂(C2H5MgBr)与酯反应可生成环丙醇衍生物(
4. 在催化剂作用下,乙基格氏试剂(C2H5MgBr)与酯反应可生成环丙醇衍生物( )。反应过程如图所示。
)。反应过程如图所示。
下列叙述错误的是( )
A、化合物1直接催化乙基格氏试剂(C2H5MgBr)与酯反应的进行 B、反应过程中Ti的成键数目保持不变。 C、化合物4和5互为同分异构体 D、乙基格氏试剂(C2H5MgBr)与乙酸甲酯的反应为CH3COOCH3 + 2C2H5MgBr C2H6+ + CH3OMgBr
5. 3体积浓硝酸和1体积浓盐酸组成的混合液叫做反王水,腐蚀能力强于王水,含有一种氧化性很强的离子(如图所示),其中不含氢元素。下列叙述错误的是( )
+ CH3OMgBr
5. 3体积浓硝酸和1体积浓盐酸组成的混合液叫做反王水,腐蚀能力强于王水,含有一种氧化性很强的离子(如图所示),其中不含氢元素。下列叙述错误的是( )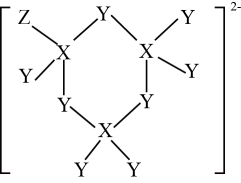 A、原子半径:r(Z)>r(X)>r( Y) B、X、Z均能与Y形成多种化合物 C、该离子中各元素原子均满足8电子稳定结构 D、X、Y、Z的气态氢化物中,沸点最高的是X的气态氢化物6. 我国科研团队开发了一种新型铠甲催化剂Ni/Co@石墨烯,可以高效去除合成气中的H2S杂质并耦合产氢,其工作原理如图所示。下列说法错误的是( )
A、原子半径:r(Z)>r(X)>r( Y) B、X、Z均能与Y形成多种化合物 C、该离子中各元素原子均满足8电子稳定结构 D、X、Y、Z的气态氢化物中,沸点最高的是X的气态氢化物6. 我国科研团队开发了一种新型铠甲催化剂Ni/Co@石墨烯,可以高效去除合成气中的H2S杂质并耦合产氢,其工作原理如图所示。下列说法错误的是( ) A、M电极为阴极,电极上发生还原反应 B、生成H2和Sx的物质的量之比为1:x C、阳极的电极反应式为xH2S- 2xe- =Sx +2xH+ D、铠甲催化剂表面的石墨烯可以保护内部金属核免受环境的影响7. 常温下,向10 mL一定浓度的硝酸银溶液中,逐滴加入0.1 mol·L-1的氨水,反应过程中- 1gc(Ag+ )或-1gc([(Ag(NH3)2]+ )与加入氨水体积的关系如图所示。下列说法错误的是( )
A、M电极为阴极,电极上发生还原反应 B、生成H2和Sx的物质的量之比为1:x C、阳极的电极反应式为xH2S- 2xe- =Sx +2xH+ D、铠甲催化剂表面的石墨烯可以保护内部金属核免受环境的影响7. 常温下,向10 mL一定浓度的硝酸银溶液中,逐滴加入0.1 mol·L-1的氨水,反应过程中- 1gc(Ag+ )或-1gc([(Ag(NH3)2]+ )与加入氨水体积的关系如图所示。下列说法错误的是( )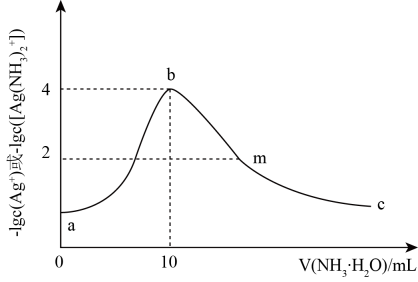 A、常温下,Kpsp(AgOH)的数量级为10-8 B、原硝酸银溶液的浓度是0.1 mol·L-1 C、溶液m点c( )-c(Ag+)-c( )=0.01 mol·L-1 D、溶液b点的浓度大于溶液m点的 浓度
A、常温下,Kpsp(AgOH)的数量级为10-8 B、原硝酸银溶液的浓度是0.1 mol·L-1 C、溶液m点c( )-c(Ag+)-c( )=0.01 mol·L-1 D、溶液b点的浓度大于溶液m点的 浓度二、综合题
-
8. 碳酸锶(SrCO3)具有屏蔽X射线的功能,广泛应用于彩色显示装置、等离子显色装置的荧光屏玻璃中。工业上以天青石(主要成分为SrSO4 , 含少量BaSO4和CaSO4)和煤为原料生产碳酸锶。工艺流程如下:

已知:①Sr(OH)2、Ba(OH)2、Ca(OH)2在不同温度下的溶解度(g):
温度/℃
20
40
60
80
90
100
Sr(OH)2
1.77
3.95
8.42
20.2
44.5
91.2
Ba(OH)2
3.89
8.22
20.94
101.4
—
—
Ca(OH)2
0.173
0.141
0. 121
0.094
0.086
0.076
②浸取时发生反应:2SrS+2H2O=Sr(HS)2+Sr(OH)2 , 硫化锶的溶解度主要受氢氧化锶的溶解度影响。
③BaSO4、SrCO3、BaCO3和SrSO4均难溶于水,在相同温度下的溶解度(S)关系如下:
S(BaSO4)≈S(SrCO3)<S(BaCO3)<S(SrSO4)。
回答下列问题:
(1)、天青石、煤混合粉碎的目的是。(2)、天青石与煤焙烧时CO还原了SrSO4 ,反应的化学方程式为。(3)、用热水浸取可以加快浸取速率,另外的主要作用是。(4)、碳化过程控制条件让硫氢化锶吸收二氧化碳有利于产品质量的提高,并且可以提供硫化氢使氢氧化锶转化为硫氢化锶。写出碳化时硫氢化锶吸收二氧化碳的化学方程式:。(5)、若达到碳化终点后继续碳化,则会使产品产率降低,结合化学方程式解释原因: , 取碳化后的料浆滴入无色酚酞试剂,若表明到达碳化终点。(6)、由于碳化所用的CO2中含有少量的O2、SO2等,在碳化时发生副反应,生成少量的SrSO3、SrSO4 , 所以要对碳化完成的碳酸锶浆进行脱硫处理。方法为加入纯碱,并加热煮沸,写出脱硫过程SrSO4与纯碱反应的化学方程式。9. 邻硝基苯酚( )、对硝基苯酚(
)、对硝基苯酚( )是两种用途广泛的有机合成中间体,实验室可用苯酚(
)是两种用途广泛的有机合成中间体,实验室可用苯酚( )进行硝化制得。实验步骤和相关装置如下(其中夹持仪器和控温装置已省略):
)进行硝化制得。实验步骤和相关装置如下(其中夹持仪器和控温装置已省略):
I.在常温下,向装置①中的三口烧瓶中加入试剂:a.水;b.NaNO3;c.浓硫酸。
II.称取一定量苯酚,与少量温水混合,并冷却至室温。
III.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在15~ 20℃。
IV.加完苯酚后,继续搅拌1 h,冷却至黑色油状物固化,倾出酸层,然后用水洗涤数次。
V.邻硝基苯酚的收集:将油层利用装置②进行水蒸气蒸馏,得邻硝基苯酚粗品。
VI.对硝基苯酚的收集:在水蒸气蒸馏的残液中,加适量水,再加浓盐酸和少量活性炭,加热煮沸,趁热过滤,冷却结晶,分离得对硝基苯酚粗品。
已知:邻硝基苯酚、对硝基苯酚室温下在水中溶解度较小,邻硝基苯酚能与水蒸气一同挥发。
(1)、装置①、②中都使用了冷凝管,其中装置①中冷凝管的主要作用是。该冷凝管的进水口是(填字母)。(2)、装置①中硝化反应放出较多热量,容易发生副反应,需要控温在15~20℃ ,使用的方法是。(3)、装置①中加入试剂的先后顺序为(填标号)。A. acb B. cab C. cba
实验中生成NaHSO4 , 写出得到邻硝基苯酚的化学方程式:。
(4)、利用装置②进行水蒸气蒸馏时,少量邻硝基苯酚晶体会凝结在冷凝管内壁造成堵塞,可以采取的简便措施为。邻硝基苯酚能用水蒸气蒸馏的原因是(答出两条合理的原因)。(5)、步骤VI中趁热过滤的目的是。10. 北京冬奥会上采用二氧化碳跨临界制冰,使人们再次看到了二氧化碳综合化利用的巨大前景。(1)、二氧化碳制冰利用了CO2的物理性质是。(2)、国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2 (g) +4H2(g) CH4(g)+2H2O(g) △H①已知H2的燃烧热△H1=- 285. 8 kJ·mol-1 , CH4的燃烧热△H2=- 890.3 kJ·mol-1 , H2O(g)=H2O(l)△H3=-44 kJ·mol-1 , 则上述反应的△H= kJ·mol-1。
②相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
c(CO2)/mol·L-1
c(H2)/ mol·L-1
c(CH4)/ mol·L-1
c(H2O)/ mol·L-1
平衡I
a
b
c
d
平衡II
m
n
x
y
a、b、c、d与m、n、x、y之间的关系式为。
(3)、二氧化碳加氢合成甲醇是人工合成淀粉的重要步骤之一,涉及的主要反应如下:I. CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H=-49.5 kJ·mol-1
II. CO(g) +2H2 (g) CH3OH(g) △H=-90.4 kJ·mol-1
III. CO2(g)+ H2(g) CO(g)+ H2O(g) △H=+40.9 kJ·mol-1
①为同时提高CO2的平衡转化率和CH3OH的平衡产率,除降低温度外,还可采取的措施是(写一条)。
②设 为相对压力平衡常数,是用相对分压(气体分压除以100kPa)代替浓度计算的平衡常数。如图为反应(填“II”或“III”)的lg随示 (n>m)的变化关系。在图中n点对应温度下、原料组成为n(CO2): n(H2)=1:3、初始总压为100 kPa的恒容密闭容器中进行反应,体系达到平衡时CO的分压为10kPa,CH3OH的分压为9kPa,H2的平衡转化率为。
 (4)、在催化剂的作用下,二氧化碳还可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率CH4选择性、CnH2n选择性的影响如图所示,从生产低级烯烃的角度考虑,最合适的反应温度是。资料显示原料气中>1时,随着的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是。
(4)、在催化剂的作用下,二氧化碳还可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率CH4选择性、CnH2n选择性的影响如图所示,从生产低级烯烃的角度考虑,最合适的反应温度是。资料显示原料气中>1时,随着的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是。 11. 氟代硼铍酸钾晶体(KBe2BO3F2)用于制造深紫外固体激光器,在国防安全、信息技术等领域有重大战略价值。上世纪90年代初,中科院院士陈创天的研究团队在国际上首先生产出大尺寸氟代硼铍酸钾晶体。实验室可用BeO、KBF4和B2O3在700℃左右灼烧获得氟代硼铍酸钾多晶料(晶胞如图所示,氧原子略去,钾原子已给出),并放出BF3气体。
11. 氟代硼铍酸钾晶体(KBe2BO3F2)用于制造深紫外固体激光器,在国防安全、信息技术等领域有重大战略价值。上世纪90年代初,中科院院士陈创天的研究团队在国际上首先生产出大尺寸氟代硼铍酸钾晶体。实验室可用BeO、KBF4和B2O3在700℃左右灼烧获得氟代硼铍酸钾多晶料(晶胞如图所示,氧原子略去,钾原子已给出),并放出BF3气体。
回答下列问题:
(1)、一群处于激发态1s22s13s1的铍原子,在回到基态的过程中,最多可发出种不同波长的光。(2)、组成氟代硼铍酸钾晶体的元素中,第一电离能最小的是(填元素符号,下同),电负性最大的是。(3)、写出生成氟代硼铍酸钾晶体的化学方程式。(4)、Be和B都容易与配体形成配位键,如[BeF4]2-、[B(OH)4] - , 从原子结构分析其原因是 , 上述离子中Be原子和B原子的杂化类型为。(5)、氟硼酸钾(KBF4)在高温下分解为KF和BF3 , KF的沸点远高于BF3的原因是。(6)、图中代表硼原子的字母为 , 该晶胞参数分别为a pm和c pm,α=β= γ=90°,则晶体密度为g·cm-3(NA表示阿伏加德罗常数的值,列出计算式)。12. 靛蓝在我国生产和使用已有三千多年的历史,古代人们是用菘蓝和蓼蓝提取的,1870年德国化学家拜耳成功合成了靛蓝,并获得1905年度诺贝尔化学奖。下面是一种合成靛蓝的方法:
已知如下信息:

回答下列问题:
(1)、A→B所用的试剂和反应条件为。(2)、C的结构简式为。(3)、D的化学名称是 , 由D生成E的反应类型为。(4)、由E生成F的化学方程式为。(5)、写出靛蓝G中含氧官能团的名称。(6)、NBS(N-溴代丁二酰亚胺)是有机合成中一种很有用的溴代剂,其结构简式为 。其同分异构体中能同时满足以下三个条件的有 个(不考虑立体异构体,填标号)。
。其同分异构体中能同时满足以下三个条件的有 个(不考虑立体异构体,填标号)。①最少有三个碳原子在一条直线上;②不含有环状结构;③含有硝基和溴原子。
a.4 b.6 c.8 d.10
其中,在同一直线上的碳原子最多且含有手性碳(注:连有四个不同的原子或基团的碳)的化合物的结构简式为。