海南省琼海市2022届高三模拟考试(三模)化学试题
试卷更新日期:2022-06-09 类型:高考模拟
一、单选题
-
1. 化学对提高人类生活质量和促进社会发展具有重要作用。下列说法正确的是( )A、焰色反应、海带提碘、石油裂化都有化学变化的过程 B、嫦娥五号返回舱用到的高温结构陶瓷,属于传统硅酸盐材料 C、利用人工合成淀粉能有效促进“碳中和”目标的实现 D、我国发射的火星探测器,其使用的太阳能电池板的主要材料是二氧化硅2. 《本草纲目》中的“石硷”(古文中“硷”同“碱”条目下写道:“采蒿蓼之属,开窖浸水,漉起,晒干烧灰,以原水淋汁……久则疑淀如石,连汁货之四方,浣衣发面,甚获利也”。上述过程没有涉及的实验操作的是( )A、溶解 B、过滤 C、蒸馏 D、结晶3. 化学与生活息息相关。下列说法错误的是( )A、活性炭具有除异味和杀菌作用 B、维生素C可用作抗氧化剂 C、聚乳酸用于制作手术缝合线 D、聚乙炔可用于制备导电高分子材料4. 下列实验中,锥形瓶内均能产生气体。试管内不能产生沉淀的是( )

选项
试剂a
试剂b
试剂c
A
浓盐酸
KClO3
AgNO3溶液
B
浓H2SO4
少量蔗糖
AlCl3溶液
C
浓氨水
CaO
MgCl2溶液
D
稀HCl
CaCO3粉末
饱和Na2CO3溶液
A、A B、B C、C D、D5. 下用列于解释事实的离子方程式正确的是( )A、铜丝插入热的浓硫酸中:Cu+2H+=Cu2++H2↑ B、向AgCl沉淀中加入过量氨水使AgCl溶解:AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O C、室温下测得NH4HSO3溶液的pH<7,主要是因为存在:+H2O⇌NH3·H2O+H+ D、向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2+++OH-=CaCO3+H2O6. SCR技术是针对柴油车尾气排放中NOx的一项处理工艺,其原理为NH3和NO在催化剂(MnO2)表面转化为N2和H2O,反应进程中的相对能量变化如图所示。下列说法错误的是( )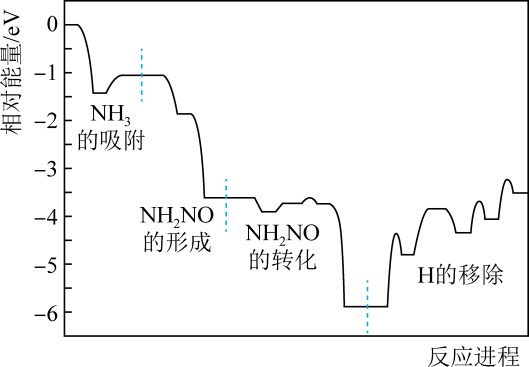 A、总反应方程式为6NO+4NH35N2+6H2O B、NH2NO是脱硝反应的活性中间体 C、催化剂的应用可降低反应焓变 D、决定反应速率的步骤是“H的移除”7. 用NA代表阿伏加德罗常数的数值。下列说法正确的是( )A、1molCaO2晶体所含离子总数为3NA B、将7.1gCl2通入水中,转移电子数为0.1NA C、常温下,1L0.1mol·L-1的氨水中含有OH-的数目为0.1NA D、标准状况下,11.2LO2、CO2混合气体含有的氧原子数为NA8. 羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在一定条件下,将CO与H2S以体积比1:2置于某刚性密闭容器中发生下列反应:CO(g)+H2S(g)⇌COS(g)+H2(g)。下列说法正确的是( )A、升高温度,H2S的浓度增大,表明该反应是吸热反应 B、通入CO后,正反应速率逐渐增大,逆反应速率不变 C、COS与H2的体积比保持不变时,说明反应达到平衡状态 D、向反应器中再通入CO,能使H2S的转化率增大9. 聚乙二醇具有优良的润滑性、保湿性,在化妆品、制药等行业中有着广泛的应用。工业上通过以下途径可以制备聚乙二醇。下列说法中错误的是( )
A、总反应方程式为6NO+4NH35N2+6H2O B、NH2NO是脱硝反应的活性中间体 C、催化剂的应用可降低反应焓变 D、决定反应速率的步骤是“H的移除”7. 用NA代表阿伏加德罗常数的数值。下列说法正确的是( )A、1molCaO2晶体所含离子总数为3NA B、将7.1gCl2通入水中,转移电子数为0.1NA C、常温下,1L0.1mol·L-1的氨水中含有OH-的数目为0.1NA D、标准状况下,11.2LO2、CO2混合气体含有的氧原子数为NA8. 羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在一定条件下,将CO与H2S以体积比1:2置于某刚性密闭容器中发生下列反应:CO(g)+H2S(g)⇌COS(g)+H2(g)。下列说法正确的是( )A、升高温度,H2S的浓度增大,表明该反应是吸热反应 B、通入CO后,正反应速率逐渐增大,逆反应速率不变 C、COS与H2的体积比保持不变时,说明反应达到平衡状态 D、向反应器中再通入CO,能使H2S的转化率增大9. 聚乙二醇具有优良的润滑性、保湿性,在化妆品、制药等行业中有着广泛的应用。工业上通过以下途径可以制备聚乙二醇。下列说法中错误的是( )乙烯
 乙二醇聚乙二醇A、环氧乙烷与乙醛互为同分异构体 B、步骤①的原子利用率为100% C、环氧乙烷中所有原子可能共平面 D、乙烯和乙二醇都可以使酸性高锰酸钾溶液褪色10. 下列对有关事实的解释正确的是( )
乙二醇聚乙二醇A、环氧乙烷与乙醛互为同分异构体 B、步骤①的原子利用率为100% C、环氧乙烷中所有原子可能共平面 D、乙烯和乙二醇都可以使酸性高锰酸钾溶液褪色10. 下列对有关事实的解释正确的是( )选项
事实
解释
A
NH3的热稳定性比PH3强
NH3分子间能形成氢键
B
基态Fe3+比Fe2+稳定
基态Fe3+价电子排布式为3d5 , 是半充满的稳定结构
C
石墨能够导电
石墨是离子晶体
D
CH4与H2O分子的空间构型不同
它们中心原子杂化轨道类型不同
A、A B、B C、C D、D11. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向溶有SO2的BaCl2溶液中通入X气体,出现白色沉淀
X气体一定具有强氧化性
B
将石蜡油高温分解产物通入酸性KMnO4溶液,溶液褪色
分解产物中一定有乙烯
C
AgNO3标准液滴定未知浓度NaCl溶液时,用K2CrO4作指示剂
Ksp(AgCl)<Ksp(Ag2CrO4)
D
常温下,分别测定浓度均为0.1 mol·L-1NaF和NaClO溶液的pH,后者大
酸性:HF>HClO
A、A B、B C、C D、D二、多选题
-
12. 某种化合物的结构式如图所示,其中W、X、Y、Z为原子序数依次增大的短周期元素,只有X、Y在同一周期,Z的单质是黄绿色气体。下列有关说法错误的是( )
 A、非金属性:X<Y B、XW4的沸点高于W2Y的沸点 C、W与Y形成的化合物中可能含有σ键、π键 D、Z2Y中所有原子最外层都满足8电子结构13. 我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如图。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述错误的是( )
A、非金属性:X<Y B、XW4的沸点高于W2Y的沸点 C、W与Y形成的化合物中可能含有σ键、π键 D、Z2Y中所有原子最外层都满足8电子结构13. 我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如图。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述错误的是( ) A、放电时,a电极反应为I2Br-+2e-=2I-+Br- B、放电时,溶液中离子的数目增大 C、充电时,b电极每增重0.65g,溶液中有0.02molI-被还原 D、充电时,a电极接外电源负极14. 常温下,向某浓度的H2C2O4溶液中缓慢滴加一定浓度的NaOH溶液,所得溶液中H2C2O4、、三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法正确的是( )
A、放电时,a电极反应为I2Br-+2e-=2I-+Br- B、放电时,溶液中离子的数目增大 C、充电时,b电极每增重0.65g,溶液中有0.02molI-被还原 D、充电时,a电极接外电源负极14. 常温下,向某浓度的H2C2O4溶液中缓慢滴加一定浓度的NaOH溶液,所得溶液中H2C2O4、、三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法正确的是( ) A、曲线3表示δ() B、草酸H2C2O4的电离常数Ka1=1.0×10-1.2 C、pH=3时,c(H2C2O4)>c()>c() D、水的电离程度:点(A)<点(B)
A、曲线3表示δ() B、草酸H2C2O4的电离常数Ka1=1.0×10-1.2 C、pH=3时,c(H2C2O4)>c()>c() D、水的电离程度:点(A)<点(B)三、综合题
-
15. Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3 , 还含有少量FeCO3、CoO、Al2O3、SiO2等)为原料制备Mn2O3的工艺流程如图。

已知:①25℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Co(OH)2
Ksp
1×10-16.3
1×10-38.6
1×10-32.3
1×10-12.7
1.09×10-15
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液:“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
回答下列问题:
(1)、MnOOH中Mn的化合价为价。(2)、为提高“酸浸”的效率,可以采取的措施为。(写一种)(3)、向“沉淀池I”中加入MnO2 , MnO2的作用是;“滤渣2”的主要成分是(填化学式)。(4)、MnSO4转化为MnOOH的离子方程式为。(5)、在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中Al3+完全沉淀,则理论上pH的最小值为(当溶液中某离子浓度c≦1.0×10-5mol·L-l时,可认为该离子沉淀完全)。16. CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。研究表明CO2与H2在催化剂存在下可发生反应制得甲烷:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。
(1)、已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH2=-571.6 kJ·mol-1
则③CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH=。
(2)、反应③的活化能Ea(正)Ea(逆)(填“>”、“=”或“<”),有利于该反应自发进行的条件是(填“高温”或“低温”)。(3)、选择合适催化剂,在密闭容器中按n(CO2):n(H2)=1:4充入反应物,反应结果如图所示。
①若N点压强为1 MPa,则平衡常数Kp(N)=MPa-2 , P点与N点的平衡常数K(P)K(N)(填“>”、“<”或“=”)。
②若无催化剂,N点平衡转化率(填“是”或“否”)可能降至R点?理由是:。
17. 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。某学习小组在实验室对高铁酸钾的制备和一些性质进行探究。回答下列问题:(1)、高铁酸钾的制备,装置如图1所示。
步骤一:将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称是 , 其侧管的作用为。
②a中制备Na2FeO4反应的离子方程式为。
③K2FeO4悬浊液经过滤、洗涤,可得粗产品。粗产品中的可溶性杂质可通过方法进一步提纯。
(2)、K2FeO4遇水转化为Fe(OH)3 , 则其能用于净水的原理为:。(3)、用图2所示装置探究K2FeO4受热分解的产物。设计实验方案证明完全分解后的固体产物中不含Fe(II):取完全分解后的少量固体,溶于稀硫酸,。 (4)、实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.9000gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用1.000mol·L-1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液15.00mL。请计算K2FeO4样品的纯度:。
(4)、实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.9000gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用1.000mol·L-1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液15.00mL。请计算K2FeO4样品的纯度:。已知:+4I-+8H+=Fe2++2I2+4H2O;I2+2=+2I-。
18. 有机物H是重要的有机化工原料,以苯酚为原料制备H的一种合成路线如下图:
已知:①R-NO2R-NH2
②
 R-CH2-COOH
R-CH2-COOH请回答:
(1)、B的化学名称为。(2)、③的反应类型为。(3)、C中所含官能团的名称为、;G的结构简式为。(4)、反应④的化学方程式为。(5)、在E的同分异构体中,写出一种符合下列条件的结构简式:。①含有2种官能团,其中一种为-NH2
②1mol该有机物可与0.5molNa2CO3反应
③苯环上有四个取代基,分子中不同化学环境的氢原子数目比为6:2: 2:1
(6)、已知:R-NH2容易被氧化;羧基为间位定位基。请参照上述合成路线和信息,以甲苯和(CH3CO)2O为原料(无机试剂任选),设计制备 的合成路线。 19. 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。(1)、基态Ge原子的价电子排布图为。(2)、Ni(CO)4常温下为无色液体,沸点42.1℃,熔点−19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是分子(“极性”或“非性极”)。(3)、Co2+可与形成配离子[Co(NO3)4]2− , 该配离子中各元素的第一电离能由小到大的顺序为(用元素符号表示),中N的杂化方式为。(4)、氨气中H−N−H键的键角为107.3°,[Zn(NH3)6]2+离子中H−N−H键的键角107.3°(填“大于”“小于”或“等于”),原因是:。(5)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( , 1,),则C点原子的坐标为;已知晶胞边长为apm,阿伏加德罗常数的值为NA , 该晶胞密度ρ为g·cm-3(只列出计算式)。
的合成路线。 19. 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。(1)、基态Ge原子的价电子排布图为。(2)、Ni(CO)4常温下为无色液体,沸点42.1℃,熔点−19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是分子(“极性”或“非性极”)。(3)、Co2+可与形成配离子[Co(NO3)4]2− , 该配离子中各元素的第一电离能由小到大的顺序为(用元素符号表示),中N的杂化方式为。(4)、氨气中H−N−H键的键角为107.3°,[Zn(NH3)6]2+离子中H−N−H键的键角107.3°(填“大于”“小于”或“等于”),原因是:。(5)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( , 1,),则C点原子的坐标为;已知晶胞边长为apm,阿伏加德罗常数的值为NA , 该晶胞密度ρ为g·cm-3(只列出计算式)。