广东省潮州市2022届高三下学期第二次模拟考试化学试题
试卷更新日期:2022-06-09 类型:高考模拟
一、单选题
-
1. 化学与生产和生活密切相关。下列过程中没有发生化学变化的是()A、氯气作水杀菌消毒剂 B、硅胶作袋装食品的干燥剂 C、二氧化硫作纸浆的漂白剂 D、肥皂水作蚊虫叮咬处的清洗剂2. 中华民族有着光辉灿烂的历史和文化。下列说法错误的是( )A、战国·曾侯乙编钟属于青铜制品,青铜是一种合金 B、秦朝·兵马俑用陶土烧制而成,属于合成高分子材料 C、宋·王希孟《千里江山图》所用纸张为宣纸,其主要成分是纤维素 D、宋·沈子藩《梅鹊图》所用缂丝中含有的桑蚕丝,其主要成分为蛋白质3. 下列有关化学用语表示正确的是( )A、次氯酸的结构式:H-Cl-O B、CaO2 的电子式:
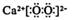 C、CO2分子的比例模型:
C、CO2分子的比例模型: 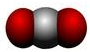 D、乙醇的分子式:CH3CH2OH
4. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,22.4 L由SO2和CO2组成的混合气体中含有的氧原子数为2NA B、25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA C、46 g乙醇中含有的极性键数目为8NA D、在反应SiO2+2CSi+2CO↑中,每1 mol SiO2被氧化,转移的电子数为4NA5. 下列装置或操作能达到实验目的是( )
D、乙醇的分子式:CH3CH2OH
4. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,22.4 L由SO2和CO2组成的混合气体中含有的氧原子数为2NA B、25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA C、46 g乙醇中含有的极性键数目为8NA D、在反应SiO2+2CSi+2CO↑中,每1 mol SiO2被氧化,转移的电子数为4NA5. 下列装置或操作能达到实验目的是( )



A.除去乙醇中的乙酸
B.形成原电池
C.制取乙酸乙酯
D.石油的蒸馏
A、A B、B C、C D、D6. 某种化合物的结构如图所示,其中X、Y、Z、Q、T、W为原子序数在20以内且原子序数依次增大的六种主族元素,Z、Q属于同一主族,W+与Q2-具有相同的电子层结构。下列说法错误的是( ) A、在溶液中,W2YZ3与XTZ反应生成YZ2 B、该化合物中含有离子键、极性键、非极性键 C、Y、Q、T的最高价氧化物对应水化物的酸性:T>Q>Y D、Y、Z、Q、T分别与X形成的简单化合物中,Z的化合物沸点最高7. a、b表示两种化合物,其结构简式分别如图所示。下列有关说法正确的是( )
A、在溶液中,W2YZ3与XTZ反应生成YZ2 B、该化合物中含有离子键、极性键、非极性键 C、Y、Q、T的最高价氧化物对应水化物的酸性:T>Q>Y D、Y、Z、Q、T分别与X形成的简单化合物中,Z的化合物沸点最高7. a、b表示两种化合物,其结构简式分别如图所示。下列有关说法正确的是( ) A、a、b与苯是同分异构体 B、a、b中6个碳原子均处于同一平面 C、a的二氯代物有五种 D、b能使溴的四氯化碳、溶液褪色,且褪色原理相同8. 在指定溶液中下列离子能大量共存的是( )A、透明澄清的溶液:NH 、Fe3+、SO 、NO B、能使甲基橙变红的溶液:Na+、Ca2+、AlO 、Cl- C、c(ClO-)=0.1mol/L的溶液:K+、Na+、CO 、S2- D、加入Al能放出H2的溶液:Mg2+、NH 、HCO 、NO9. 下列物质性质和用途都正确且相关的是( )
A、a、b与苯是同分异构体 B、a、b中6个碳原子均处于同一平面 C、a的二氯代物有五种 D、b能使溴的四氯化碳、溶液褪色,且褪色原理相同8. 在指定溶液中下列离子能大量共存的是( )A、透明澄清的溶液:NH 、Fe3+、SO 、NO B、能使甲基橙变红的溶液:Na+、Ca2+、AlO 、Cl- C、c(ClO-)=0.1mol/L的溶液:K+、Na+、CO 、S2- D、加入Al能放出H2的溶液:Mg2+、NH 、HCO 、NO9. 下列物质性质和用途都正确且相关的是( )选项
性质
用途
A
FeCl3溶液显酸性
用于刻蚀电路板
B
SO2具有氧化性
SO2常用于漂白秸秆、织物
C
HF溶液具有酸性
HF溶液能在玻璃上刻图案
D
CH3CH2OH完全燃烧生成二氧化碳和水并放出大量热量
乙醇常作清洁能源
A、A B、B C、C D、D10. 臭氧层中O3分解过程如图所示,下列说法正确的是( ) A、催化反应①②均为放热反应 B、决定O3分解反应速率的是催化反应② C、E1是催化反应①对应的正反应的活化能,(E2+E3)是催化反应②对应的逆反应的活化能 D、温度升高,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,且平衡常数增大11. 下列有关实验操作、现象和结论都正确的是( )
A、催化反应①②均为放热反应 B、决定O3分解反应速率的是催化反应② C、E1是催化反应①对应的正反应的活化能,(E2+E3)是催化反应②对应的逆反应的活化能 D、温度升高,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,且平衡常数增大11. 下列有关实验操作、现象和结论都正确的是( )选项
操作
现象
结论
A
向20%蔗糖溶液中加入少量稀 , 加热,一段时间后,再加入银氨溶液
为出现银镜
蔗糖未水解
B
测量熔融状态下的导电性
能导电
熔融状态下能电离出、、
C
用石墨作电极电解、的混合溶液
阴极上先析出铜
还原性:Mg>Cu
D
向溶液中先通入足量 , 再通入气体
无沉淀生成
不能和反应生成和HCl
A、A B、B C、C D、D12. 向某密闭容器中充入NO2 , 发生反应:2NO2(g) N2O4(g)(已知:N2O4为无色气体)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:/℃
27
35
49
70
NO2%
20
25
40
66
N2O4%
80
75
60
34
下列说法正确的是( )
A、平衡时,v(NO2消耗)=2v(N2O4消耗) B、27℃时,该平衡体系中NO2的转化率为80% C、升高温度,该反应的化学平衡常数增大 D、温度不变,缩小容器体积,达平衡时气体颜色变浅13. 一种氯离子介导的电化学合成方法,能将乙烯高效清洁、选择性地转化为环氧乙烷,电化学反应的具体过程如图所示。在电解结束后,将阴、阳极电解液输出混合,便可反应生成环氧乙烷。下列说法错误的是( )
 A、Ni电极与电源正极相连 B、该过程的总反应为:CH2=CH2+H2O→
A、Ni电极与电源正极相连 B、该过程的总反应为:CH2=CH2+H2O→ +H2
C、工作过程中阴极附近pH增大
D、在电解液混合过程中会发生反应:
14. 工业上用CO2合成乙酸的反应路径如图所示:
+H2
C、工作过程中阴极附近pH增大
D、在电解液混合过程中会发生反应:
14. 工业上用CO2合成乙酸的反应路径如图所示:
下列说法错误的是( )
A、反应过程中碳元素的化合价始终不变 B、第4步反应的氧化剂是CH3COORh*I C、HI、LiOH、CH3I、CH3Rh*I、CH3COORh*I为反应的中间产物 D、催化循环的总反应为CH3OH+CO2+H2 CH3COOH+H2O15. 绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程: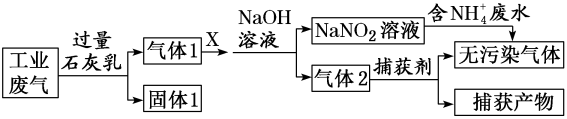
下列说法错误的是( )
A、固体1中主要含有CaCO3、CaSO3、Ca(OH)2 B、X可以是空气,但不能过量 C、捕获剂所捕获的气体主要是CO、N2 D、处理含废水时,发生的反应为:+=N2↑+2H2O16. 一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是( ) A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10-13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化
A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10-13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化二、综合题
-
17. 亚氯酸钠()是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 , 是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白。过氧化氢法制备固体的实验装置如图所示:

已知:
①的熔点为-59℃、沸点为11℃,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生分解,若用空气、、氮气等气体稀释时,爆炸性则降低。
②
回答下列问题:
(1)、按上图组装好仪器后,首先应该进行的操作是;装置B的作用是;冰水浴冷却的主要目的不包括(填字母)。a.减少的分解 b.降低的溶解度 c.减少的分解
(2)、是合成的重要原料,写出三颈烧瓶中生成的化学方程式:。(3)、装置C中加入NaOH溶液的目的除了作反应物外,还因为。空气的流速过慢时,不能及时被移走,浓度过高导致分解可能发生爆炸;空气流速过快时,则导致。(4)、该套装置存在的明显缺陷是。(5)、为防止生成的固体被继续还原为NaCl,所用还原剂的还原性应适中。除外,还可以选择的还原剂是____(填字母)A、过氧化钠 B、硫化钠 C、氯化亚铁 D、高锰酸钾(6)、若mg最终制得纯净的ng , 则的产率是×100%。(相对分子质量分别是:106.5 :90.5)18. 二氧化碳的回收利用是环保领域研究的热点课题。(1)、在太阳能的作用下,以为原料制取炭黑的流程如图甲所示。其总反应的化学方程式为。 (2)、经过催化氢化合成低碳烯烃。其合成乙烯的反应为 。
(2)、经过催化氢化合成低碳烯烃。其合成乙烯的反应为 。几种物质的能量(在标准状况下规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
物质
能量
0
-394
52
-242
则。
(3)、在2L恒容密闭容器中充入2mol和nmol , 在一定条件下发生反应: , 的转化率与温度、投料比[]的关系如图乙所示。
①(填“>”“<”或“=”,下同) , 平衡常数。
②TK时,某密闭容器中发生。上述反应,反应进行到不同时间测得各物质的浓度如下表:
时间浓度/mol/L
物质
0
10
20
30
40
50
6.00
5.40
5.10
9.00
8.40
8.40
2.00
1.80
1.70
3.00
2.80
2.80
0
0.10
0.15
3.20
3.30
3.30
20~30min间只改变了某一条件,根据表中的数据判断改变的条件可能是(填字母)。
A.通入一定量 B.通入一定量
C.加入合适的催化剂 D.缩小容器容积
(4)、在催化剂M的作用下,和同时发生下列两个反应:Ⅰ.
Ⅱ.
图丙是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是____(填字母)。
 A、催化剂M的活性降低 B、反应Ⅰ的平衡常数变大 C、生成甲醚的量增加 D、反应Ⅱ的活化能增大(5)、溶液通常用来捕获 , 常温下,的第一步、第二步电离常数分别为 , , 则常温下,的溶液的pH等于(不考虑的第二步水解和的电离)。19. 水泥是重要的建筑材料。水泥熟料的主要成分为CaO、 , 并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
A、催化剂M的活性降低 B、反应Ⅰ的平衡常数变大 C、生成甲醚的量增加 D、反应Ⅱ的活化能增大(5)、溶液通常用来捕获 , 常温下,的第一步、第二步电离常数分别为 , , 则常温下,的溶液的pH等于(不考虑的第二步水解和的电离)。19. 水泥是重要的建筑材料。水泥熟料的主要成分为CaO、 , 并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)、在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是 , 还可使用代替硝酸。(2)、沉淀A的主要成分是 , 其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为。(3)、加氨水过程中加热的目的是。沉淀B的主要成分为、(填化学式)(4)、草酸钙沉淀经稀处理后,用标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:。实验中称取0.400g水泥样品,滴定时消耗了的溶液36.00mL,则该水泥样品中钙的质量分数为 , (相对原子质量Ca:40)20. 人类对物质结构的探索永无止境。回答下列问题:(1)、碳硼烷酸[化学式为H(CHB11Cl11)是目前世界上已知的最强酸,但腐蚀性很小,可以作为无污染的酸催化剂。现代化学中常利用的特征谱线来鉴定元素。组成碳硼烷酸的4种元素中,基态原子中未成对电子数最多的是(填电子排布式)。(2)、石墨炔是我国科学家在2010年首次制得一种新的碳的同素异形体,其中一种结构如图所示,石墨炔中碳原子的杂化类型为。 (3)、硼元素具有缺电子性。自然界中含硼元素的钠盐是—种天然矿藏,其化学式写作Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]•8H2O。其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___(填字母)。
(3)、硼元素具有缺电子性。自然界中含硼元素的钠盐是—种天然矿藏,其化学式写作Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]•8H2O。其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___(填字母)。 A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键(4)、镓与硼元素处于同一主族,GaN是制造5G芯片的材料,可发出紫外光。
A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键(4)、镓与硼元素处于同一主族,GaN是制造5G芯片的材料,可发出紫外光。①科学家合成了一种阳离子为“N5n+”其结构是对称的,5个N排成“V”形,每个N原子的最外层都达到8电子稳定结构、且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,N8中阴离子的空间构型为 , 写出一种与其互为等电子体的分子(填化学式)。
②Ga和As两种元素电负性相差不大,能形成化合物GaAs。GaAs的熔点为1238℃,其晶胞结构如图所示。

已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为 , GaAs的熔点(填“高于”或“低于”)GaN,其理由是。若Ga和As的原子半径分别为rGa和rAs , 则GaAs晶胞中原子的体积占晶胞体积的百分率为(列出计算式即可)。
21.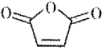 是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。
是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。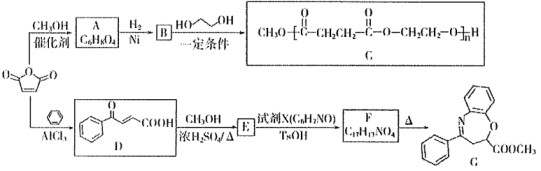
已知:R1OH+

 (1)、A中的含氧官能团名称是。(2)、D→E的反应类型是。(3)、E的分子式是;F的结构简式是。(4)、B→C的化学方程式为。(5)、W是B的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成44g , W共有种(不考虑立体异构),其中核磁共振氢谱为三组峰的结构简式为。(6)、设计由甲苯和
(1)、A中的含氧官能团名称是。(2)、D→E的反应类型是。(3)、E的分子式是;F的结构简式是。(4)、B→C的化学方程式为。(5)、W是B的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成44g , W共有种(不考虑立体异构),其中核磁共振氢谱为三组峰的结构简式为。(6)、设计由甲苯和 为原料制备化合物
为原料制备化合物 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。