北京市朝阳区2022届高三 二模化学试题
试卷更新日期:2022-06-09 类型:高考模拟
一、单选题
-
1. 下列我国科研成果所涉及的物质转化中,物质所含元素位于0族的是( )A、由二氧化碳制取汽油:
 等
B、液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C、煤炭的清洁化利用:煤炭→
D、利用太阳能合成燃料:
2. 下列说法错误的是( )A、疫苗等生物制剂需要在低温下保存 B、在伤口处涂抹医用酒精可消毒、杀菌 C、蛋白质、氨基酸中均含有
等
B、液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C、煤炭的清洁化利用:煤炭→
D、利用太阳能合成燃料:
2. 下列说法错误的是( )A、疫苗等生物制剂需要在低温下保存 B、在伤口处涂抹医用酒精可消毒、杀菌 C、蛋白质、氨基酸中均含有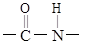 D、蛋白质水解可以得到氨基酸
3. 下列关于的化学用语或图示表达错误的是( )
D、蛋白质水解可以得到氨基酸
3. 下列关于的化学用语或图示表达错误的是( ) A、醋酸溶液呈酸性: B、一定条件下,与反应能生成 C、测定相对分子质量的质谱如图 D、0.1醋酸溶液中,4. 下列关于第ⅣA族元素及相关物质的性质比较中,错误的是( )A、热稳定性:CH4>SiH4>GeH4 B、酸性:CH3COOH>H2CO3>H2SiO3 C、熔点:金刚石>晶体硅>晶体锗 D、第一电离能:C<Si<Ge5. 下列过程所用的物质中,利用了其氧化性的是( )A、用溶液腐蚀覆铜板 B、用块防止钢铁船体腐蚀 C、用的水溶液吸收 D、用粉防止溶液氧化6. 汽车尾气中的、、碳氢化合物通过排气系统的净化装置(催化剂主要由、、等物质和稀土材料组成)转化为无害气体,净化原理如下。下列分析错误的是( )
A、醋酸溶液呈酸性: B、一定条件下,与反应能生成 C、测定相对分子质量的质谱如图 D、0.1醋酸溶液中,4. 下列关于第ⅣA族元素及相关物质的性质比较中,错误的是( )A、热稳定性:CH4>SiH4>GeH4 B、酸性:CH3COOH>H2CO3>H2SiO3 C、熔点:金刚石>晶体硅>晶体锗 D、第一电离能:C<Si<Ge5. 下列过程所用的物质中,利用了其氧化性的是( )A、用溶液腐蚀覆铜板 B、用块防止钢铁船体腐蚀 C、用的水溶液吸收 D、用粉防止溶液氧化6. 汽车尾气中的、、碳氢化合物通过排气系统的净化装置(催化剂主要由、、等物质和稀土材料组成)转化为无害气体,净化原理如下。下列分析错误的是( )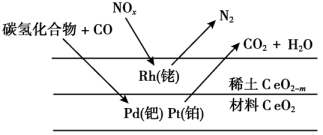 A、催化剂能提高反应速率 B、、均发生了氧化反应 C、转化为时,转化为 D、催化剂对化学反应有选择性7. 下列方程式不能合理解释实验现象或事实的是( )A、电解饱和溶液产生黄绿色气体: B、湿润的淀粉碘化钾试纸遇氯气变蓝: C、钢铁发生吸氧腐蚀,正极反应: D、用除去输水管道中的氧气:8. 。下列分析错误的是( )A、氮分子的键能大,断开该键需要较多能量 B、增大合成氨的反应速率与提高平衡混合物中氨的含量所采取的措施均一致 C、平衡混合物中的沸点最高,液化、分离出能提高其产率 D、断裂1和3的共价键所需能量小于断裂2的共价键所需能量9. 选择不同的反应探究化学反应速率的影响因素,所用试剂不合理的是( )
A、催化剂能提高反应速率 B、、均发生了氧化反应 C、转化为时,转化为 D、催化剂对化学反应有选择性7. 下列方程式不能合理解释实验现象或事实的是( )A、电解饱和溶液产生黄绿色气体: B、湿润的淀粉碘化钾试纸遇氯气变蓝: C、钢铁发生吸氧腐蚀,正极反应: D、用除去输水管道中的氧气:8. 。下列分析错误的是( )A、氮分子的键能大,断开该键需要较多能量 B、增大合成氨的反应速率与提高平衡混合物中氨的含量所采取的措施均一致 C、平衡混合物中的沸点最高,液化、分离出能提高其产率 D、断裂1和3的共价键所需能量小于断裂2的共价键所需能量9. 选择不同的反应探究化学反应速率的影响因素,所用试剂不合理的是( )a.(观察气泡产生的快慢)
b.(观察浑浊产生的快慢)
反应
影响因素
所用试剂
A
a
接触面积
块状CaCO3、0.5 mol/L HCl
粉末状CaCO3、0.5 mol/L HCl
B
a
H+浓度
块状CaCO3、0.5 mol/L HCl
块状CaCO3、3.0 mol/LHCl
C
b
H+浓度
0.1 mol/L Na2S2O3、稀H2SO4
0.1mol/L Na2S2O3、浓H2SO4
D
b
温度
0.1 mol/L Na2S2O3、0.1 Na2S2O3 H2SO4、冷水
0.1 mol/L Na2S2O3、0.1 Na2S2O3 H2SO4、热水
A、A B、B C、C D、D10. 某同学进行如下实验:实验
实验现象
ⅰ
将铜粉加入试管中,再加入稀
溶液变蓝,液面上方呈浅红棕色;至不再产生气泡时,铜粉有剩余,余液呈酸性
ⅱ
继续向ⅰ中试管加入少量固体
又产生气泡,铜粉减少,液面上方呈浅红棕色
ⅲ
取饱和溶液,加入少量固体和铜粉
无明显变化
下列说法错误的是( )
A、氧化性的强弱与其浓度大小有关 B、ⅰ、ⅱ中铜粉减少的原因能用相同的离子反应解释 C、ⅰ中余液呈酸性的主要原因是 D、用一定浓度的与也能使铜粉溶解11. 取1.0L浓缩卤水(、浓度均为)进行实验:滴加一定量溶液,产生黄色沉淀;继续滴加,产生白色沉淀。已知:、。下列分析错误的是( )A、黄色沉淀是 , 白色沉淀是 B、产生白色沉淀时,溶液中存在 C、若起始时向卤水中滴加2滴(0.1) , 能产生沉淀 D、白色沉淀开始析出时,12. 我国科研人员将单独脱除的反应与的制备反应相结合,实现协同转化。①单独制备: , 不能自发进行。
②单独脱除: , 能自发进行协同转化装置如下图(在电场作用下,双极膜中间层的解离为和 , 并向两极迁移)。
下列分析错误的是( )
 A、反应②释放的能量可以用于反应① B、产生的电极反应: C、反应过程中不需补加稀 D、协同转化总反应:13. 高分子M广泛用于纺织、涂料等产品,合成路线如下:
A、反应②释放的能量可以用于反应① B、产生的电极反应: C、反应过程中不需补加稀 D、协同转化总反应:13. 高分子M广泛用于纺织、涂料等产品,合成路线如下:
已知:

下列说法错误的是( )
A、化合物A不存在顺反异构体 B、A是的同系物 C、A→N为聚合反应 D、M、N均可水解得到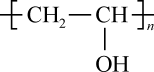 14. 以、为原料合成涉及的主要反应如下:
14. 以、为原料合成涉及的主要反应如下:①
②
的平衡转化率()、的选择性()随温度、压强变化如下:

已知:
下列分析错误的是( )
A、 B、400℃左右,体系发生的反应主要是② C、由图可知, , D、初始、 , 平衡后、 , 若只发生①、②,则的平衡转化率为24%二、综合题
-
15. 青蒿素()是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
 (1)、提取青蒿素
(1)、提取青蒿素在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚()提取,效果更好。
①乙醚的沸点低于乙醇,原因是。
②用乙醚提取效果更好,原因是。
(2)、确定结构①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。比较青蒿素分子中C、H、O的原子核附近电子云密度大小:。
②图中晶胞的棱长分别为a、b、c , 晶体的密度为。(用表示阿伏加德罗常数;;青蒿素的相对分子质量为282)
③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)、修饰结构,提高疗效一定条件下,用将青蒿素选择性还原生成双氢青蒿素。

①双氢青蒿素分子中碳原子的杂化轨道类型为。
②的空间结构为。
双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。
16. 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下: (1)、反应Ⅰ由两步反应组成:
(1)、反应Ⅰ由两步反应组成:①;
②。
(2)、反应Ⅱ:①不同条件下,达到相同的平衡转化率,温度越高,所需的压强越大,0。
②一定压强下,与的投料比[]对体系中平衡转化率的影响如下:

时,解释平衡转化率随投料比增大而降低的原因:。
(3)、可以作为水溶液中歧化反应的催化剂。可能的催化过程如下:①ⅰ.
ⅱ.。
②反应结束后,分离混合物[硫酸(含、)、S(吸附了)等],从中获得固体S以及与的混合液,便于循环利用。
a.该过程中,应选取的化学试剂是。
b.根据所选取的化学试剂,设计方案,得到S以及与的混合液。实验方案是:。(用简要文字说明即可)
17. 用零价铁()去除含氮废水中的硝酸盐()是环境修复的重要方法。一种去除的过程如下。 (1)、Ⅱ中充分反应后,分离混合物的方法是。(2)、Ⅱ中反应的离子方程式是。(3)、实验发现,在Ⅱ中补充一定量的可以明显提高的去除率。向两份含氮废水[]中均加入足量粉,做对比研究。
(1)、Ⅱ中充分反应后,分离混合物的方法是。(2)、Ⅱ中反应的离子方程式是。(3)、实验发现,在Ⅱ中补充一定量的可以明显提高的去除率。向两份含氮废水[]中均加入足量粉,做对比研究。实验序号
ⅰ
ⅱ
所加试剂
粉
粉、()
的去除率
≈50%
≈100%
分析ⅱ中的去除率提高的原因:
a.直接还原了。
通过计算说明电子得、失数量关系: , 证明该原因不合理。
b.研究发现:(导电)覆盖在铁粉表面;随着反应的进行,产生(不导电),它覆盖在表面,形成钝化层,阻碍电子传输。
c.能与反应生成。
用做同位素示踪实验,证明该原因合理。
d.破坏钝化层。
将ⅱ中的替换为 , 的去除率约为50%,证明该原因不合理。
(4)、ⅰ、ⅱ中均能发生。该反应明显有助于ⅰ中的去除,结合方程式解释原因:。(5)、测定含量步骤1.取v含氮()水样,加入催化剂、标准溶液(过量),再加入稀。
步骤2.用标准溶液滴定剩余的(被还原为),终点时消耗。
已知:
①水样中的含量为。
②溶液中影响测定。向步骤1中加入适量 , 产生驱赶 , 否则会使测定结果(填“偏大”或“偏小”)。
18. 褪黑激素的前体K的合成路线如下。
已知:
 (R表示烃基或氢)(1)、A能发生银镜反应。A中所含的官能团有。(2)、D→E的反应类型是。(3)、试剂W的分子式是 , 其结构简式是。(4)、G中只含酯基一种官能团。生成G的反应方程式是。(5)、F的分子式为。M的结构简式是。(6)、由K合成Q(
(R表示烃基或氢)(1)、A能发生银镜反应。A中所含的官能团有。(2)、D→E的反应类型是。(3)、试剂W的分子式是 , 其结构简式是。(4)、G中只含酯基一种官能团。生成G的反应方程式是。(5)、F的分子式为。M的结构简式是。(6)、由K合成Q( ),Q再经下列过程合成褪黑激素。
),Q再经下列过程合成褪黑激素。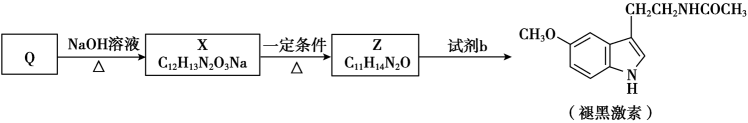
①X的结构简式是。
②Z的结构简式是。
③试剂b是。
19. 某小组探究氧化性、还原性的变化规律。资料:、
(1)、制备:将溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀 , 得溶液B。溶用冰水,目的是。(2)、检验:向溶液A、B中分别滴加适量酸性溶液。Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
发生还原反应:
发生氧化反应:。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 , 对其产生的原因提出猜想:
猜想1.有氧化性,能被还原为
猜想2.有性,能与反应产生
猜想3.……
(3)、探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:序号
实验
试剂
现象
ⅰ
a
生成棕褐色固体,产生大量气泡
ⅱ
b
有少量气泡
ⅲ
溶液
有少量气泡
ⅲ是ⅱ和ⅰ的对照实验。
①X是。
②a是、b是。
③取ⅰ中棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体。
(4)、向一定浓度的溶液中加入少量 , 迅速产生大量气泡;随后加入 , 固体溶解,气泡产生明显减弱。结合方程式解释原因。(5)、综上,做氧化剂还是做还原剂,与等因素有关。