安徽省淮南市2022届高三第二次模拟考试理科综合化学试题
试卷更新日期:2022-06-09 类型:高考模拟
一、单选题
-
1. 2022年北京冬奥会被誉为科技奥运绿色奥运,从清洁能源到环保材料,化学高科技所起的作用功不可没。下列有关说法错误的是( )A、二氧化碳跨临界直冷制冰技术环保节能安全无毒 B、颁奖礼服内胆添加的石墨烯发热材料为有机高分子材料 C、滑雪服采用的剪切增稠流体材料可有效减小空气阻力 D、冬奥火炬“飞扬”外壳采用的是碳纤维与高性能树脂制成的新型复合材料2. 以葡萄糖为原料制得的异山梨醇(如图)是重要的生物质转化平台化合物。下列关于该物质的叙述错误的是( )
 A、一氯代物有3种(不含立体异构) B、与己二酸互为同分异构体 C、分子中所有原子可能共平面 D、能发生取代、氧化和消去反应3. 在实验室采用如图所示装置进行气体的干燥、收集和尾气处理,合理的是( )
A、一氯代物有3种(不含立体异构) B、与己二酸互为同分异构体 C、分子中所有原子可能共平面 D、能发生取代、氧化和消去反应3. 在实验室采用如图所示装置进行气体的干燥、收集和尾气处理,合理的是( )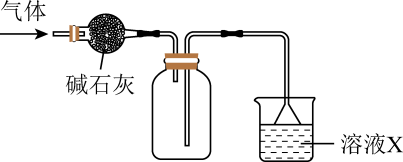
选项
气体
溶液X
A
NO
氢氧化钠溶液
B
NH3
水
C
SO2
氢氧化钠溶液
D
Cl2
饱和食盐水
A、A B、B C、C D、D4. N-异丙基丙烯酰胺可形成一种高分子膜,在一定温度范围内有温敏特性(如下下图所示),其结构中具有亲水性的酰胺基和疏水性的异丙基。下列有关说法错误的是( ) A、可通过加聚反应合成高分子膜 B、升温时高分子膜中有O-H键的形成 C、高分子膜在低温时以亲水作用为主 D、高分子膜在高温时会发生体积收缩5. 一种由原子序数依次增大的短周期主族元素W、X、Y、Z组成的化合物在化学和医药工业中常用作还原剂(如图所示,其中一表示化学键,可能为单键或双键),X最外层电子数为电子层数的3倍。下列叙述正确的是( )
A、可通过加聚反应合成高分子膜 B、升温时高分子膜中有O-H键的形成 C、高分子膜在低温时以亲水作用为主 D、高分子膜在高温时会发生体积收缩5. 一种由原子序数依次增大的短周期主族元素W、X、Y、Z组成的化合物在化学和医药工业中常用作还原剂(如图所示,其中一表示化学键,可能为单键或双键),X最外层电子数为电子层数的3倍。下列叙述正确的是( ) A、简单离子半径:Z>Y>X>W B、Y与X、Y与W形成的化合物化学键类型一定相同 C、X与Z形成的化合物中各原子均满足8电子稳定结构 D、Z的最高价氧化物对应的水化物酸性强于碳酸6. 如图为一种酶生物电池,可将葡萄糖(C6H12O6)转化为葡萄糖内酯(C6H10O6),两个碳纳米管电极材料由石墨烯片层卷曲而成。下列说法正确的是( )
A、简单离子半径:Z>Y>X>W B、Y与X、Y与W形成的化合物化学键类型一定相同 C、X与Z形成的化合物中各原子均满足8电子稳定结构 D、Z的最高价氧化物对应的水化物酸性强于碳酸6. 如图为一种酶生物电池,可将葡萄糖(C6H12O6)转化为葡萄糖内酯(C6H10O6),两个碳纳米管电极材料由石墨烯片层卷曲而成。下列说法正确的是( ) A、图中的离子交换膜为阴离子交换膜 B、负极区发生的电极反应主要为H2-2e-=2H+ C、碳纳米管有良好导电性能,且能高效吸附气体 D、理论上消耗标况下2.24LO2 , 可生成葡萄糖内酯0.2mol7. 实验测得0.10mol/LNaHCO3溶液的pH随温度变化如图所示。下列说法正确的是( )
A、图中的离子交换膜为阴离子交换膜 B、负极区发生的电极反应主要为H2-2e-=2H+ C、碳纳米管有良好导电性能,且能高效吸附气体 D、理论上消耗标况下2.24LO2 , 可生成葡萄糖内酯0.2mol7. 实验测得0.10mol/LNaHCO3溶液的pH随温度变化如图所示。下列说法正确的是( ) A、OM段随温度升高溶液的pH减小,原因是水解被抑制 B、O点溶液和P点溶液的c(OH-)相等 C、将N点溶液恢复到25℃,pH=8.62 D、Q点、M点溶液均有c()+c()+c(H2CO3)=0.10mol/L
A、OM段随温度升高溶液的pH减小,原因是水解被抑制 B、O点溶液和P点溶液的c(OH-)相等 C、将N点溶液恢复到25℃,pH=8.62 D、Q点、M点溶液均有c()+c()+c(H2CO3)=0.10mol/L二、综合题
-
8. 锗是一种稀散金属,在光纤通信、航空航天等领域有广泛应用,模拟从氧化锌烟灰(成分有ZnO、ZnO·GeO2、FeO·GeO2、Fe2O3·GeO2、PbO等)中提取锗元素的流程图如下:
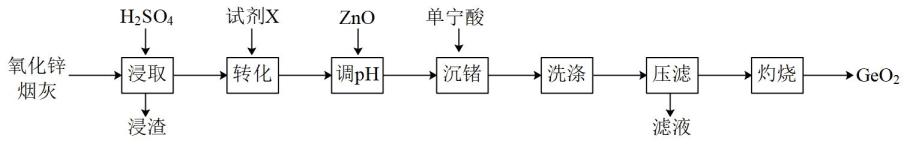
已知:①浸取后溶液pH为2,Ge以GeO2+的形式存在;
②单宁酸为复杂有机酸,易与Fe3+络合沉淀。
(1)、浸取时ZnO·GeO2发生反应的化学方程式是 , 浸渣的主要成分是。(2)、试剂X的作用是。(3)、下图为沉锗时溶液pH对锗沉淀率的影响,则适宜的pH应为____(填标号)。 A、1.0 B、2.0 C、2.5 D、3.0(4)、沉锗时有一段沉锗和二段沉锗两种工艺,单宁酸用量与锗沉淀率关系如表所示,工业常用二段沉锗工艺且单宁酸总用量为25倍,其原因是。
A、1.0 B、2.0 C、2.5 D、3.0(4)、沉锗时有一段沉锗和二段沉锗两种工艺,单宁酸用量与锗沉淀率关系如表所示,工业常用二段沉锗工艺且单宁酸总用量为25倍,其原因是。一段沉锗单宁酸总用量/倍
10
15
20
25
30
锗沉淀率/%
88.5
89.5
90.5
91.5
93.5
二段沉锗单宁酸总用量/倍
10
15
20
25
30
锗沉淀率/%
92
93.5
94.5
97
97.5
(5)、可从滤液中回收的金属元素主要有。(6)、若用C2H2O表示单宁酸,压滤后的含锗沉淀表示为GeO(C2H2O)2SO4 , 其在空气中灼烧会得到SO2、H2O、CO2三种气体,该反应方程式为。9. CuCl为白色固体,微溶于水,不溶于酒精,在空气中能被迅速氧化,是重要的工业催化剂。某化学兴趣小组同学对其制备过程进行了实验探究。(1)、I.小组同学首先用如图装置制备CuCl2。
仪器a的名称为NaOH溶液的作用是。
(2)、三颈烧瓶中发生反应的离子方程式为。(3)、II.查阅资料后,小组同学用(NH4)2SO3还原CuCl2溶液来制备CuCl。制备反应的离子方程式为。
(4)、将混合物过滤、洗涤、干燥可得CuCl产品。①过滤操作最好采用抽滤法快速过滤,这样可避免;
②判断CuCl沉淀洗涤干净的实验方案是。
(5)、研究发现,CuCl的产率与CuCl2起始浓度、溶液pH的关系如下图。
①随着pH增大,CuCl2浓度逐渐降低的原因是;
②控制溶液的pH在时,CuCl产率最高。
10. CO2减排策略主要有三种:减少排放,捕集封存,转化利用。其中CO2转化利用,生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。由CO2转化制甲醇具有重要的经济效益。(1)、高效催化剂对CO2加氢制甲醇的反应速率影响很大。通过计算机分析,CO2加氢制甲醇在不同催化条件下存在两种反应路径的势能图如下图所示。
①CO2加氢制甲醇的热化学方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=eV/mol(阿伏加德罗常数用NA表示);
②(填“甲酸盐”或“羧酸”)路径更有利于CO2加氢制甲醇反应,对该路径的反应速率影响最大的一步反应是;
③根据势能图,下列说法合理的是(填标号)。
A.CO2分压越大,催化剂表面积越大,CO2在催化剂表面的吸附速率越大
B.不考虑H3COH*,两种路径中产生的含碳中间体种类均有5种
C.中间体HCOO*比COOH*更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率
(2)、CO2催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arrhenius经验公式为(其中Ea为活化能,k为速率常数,R和C为常数)。
①该反应的活化能Ea=kJ/mol;
②当使用更高效的催化剂时,在图中画出Rlnk与关系的示意图。
(3)、在CO2催化加氢制甲醇过程中也存在竞争反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0,在恒温密闭容器中,维持压强和投料比不变,将CO2和H2按一定流速通过反应器,CO2转化率和甲醇选择性[x(CH3OH)%=]随温度变化关系如下图所示:
CO2转化率和甲醇选择性随温度的变化曲线
①若233-251℃时催化剂的活性受温度影响不大,分析235℃后图中曲线下降的原因。
②在压强为P的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为20%,甲醇的选择性为50%,计算CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)在该温度下的平衡常数Kp=。(列出计算式)
11. 完成下列问题。(1)、对于基态K原子,下列叙述正确的是____(填标号)。A、元素K的焰色反应呈紫红色,在可见光范围内辐射波长较短 B、K的核外电子排布式为[Ar]4s1 C、K和Cr位于同一周期,且价电子构型相同,第一电离能I1(K)>I1(Cr)(2)、g-C3N4是一种近似石墨烯的平面维片层结构,其中一种基本结构单元无限延伸形成网状结构如下图所示:
g-C3N4中N原子的杂化类型 , 片层之间通过(填作用力类型)结合,g-C3N4在光激发下能传递电子的原因是。
(3)、NaCl的熔点为801℃,KCl的熔点为770℃,请分析原因。(4)、研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引力或排斥力。设氯化钠晶胞参数为apm,钠离子和氯离子的半径分别为rNapm和rClpm,以钠离子为中心,距离最近的一层为第一层。
则第二层离子有个,与中心离子的距离为pm,它们是离子(填“钠”或“氯”),晶胞中的离子空间占有率为(列出计算表达式)。
12. 化合物W是合成风湿性关节炎药物罗美昔布的一种中间体,其合成路线如下:
已知:(i)

(ii)
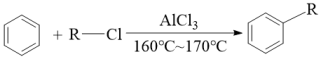
回答下列问题:
(1)、A的化学名称是 , B中具有的官能团的名称是 ,(2)、由C生成D的反应类型是。(3)、D→E和F→G的作用是。(4)、写出由G生成H的化学方程式。(5)、写出I的结构简式。(6)、X的同分异构体中,符合下列条件的有机物有种。i)只含两种官能团且不含甲基;
ii)含-CH2Br结构,不含C=C=C和环状结构。
(7)、设计由甲苯和 制备
制备 的合成路线试剂任选)。
的合成路线试剂任选)。