浙江省2022 年1月普通高校招生选考科目考试化学试题
试卷更新日期:2022-06-07 类型:高考真卷
一、单选题
-
1. 水溶液呈酸性的盐是( )A、NH4Cl B、BaCl2 C、H2SO4 D、Ca(OH)22. 下列物质属于非电解质的是( )A、CH4 B、KI C、NaOH D、CH3COOH3. 名称为“干燥管”的仪器是( )A、
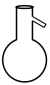 B、
B、 C、
C、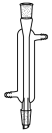 D、
D、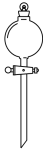 4. 下列物质对应的化学式不正确的是( )A、氯仿:CHCl3 B、黄铜矿的主要成分:Cu2S C、芒硝:Na2SO4·10H2O D、铝土矿的主要成分:Al2O35. 下列表示不正确的是( )A、乙炔的结构简式HC≡CH B、KOH的电子式
4. 下列物质对应的化学式不正确的是( )A、氯仿:CHCl3 B、黄铜矿的主要成分:Cu2S C、芒硝:Na2SO4·10H2O D、铝土矿的主要成分:Al2O35. 下列表示不正确的是( )A、乙炔的结构简式HC≡CH B、KOH的电子式 C、乙烷的球棍模型:
C、乙烷的球棍模型: D、氯离子的结构示意图:
D、氯离子的结构示意图: 6. 下列说法不正确的是( )A、液化石油气是纯净物 B、工业酒精中往往含有甲醇 C、福尔马林是甲醛的水溶液 D、许多水果和花卉有芳香气味是因为含有酯7. 下列说法不正确的是( )A、32S和34S互为同位素 B、C70和纳米碳管互为同素异形体 C、CH2ClCH2Cl和CH3CHCl2互为同分异构体 D、C3H6和C4H8一定互为同系物8. 下列说法不正确的是( )A、镁合金密度较小、强度较大,可用于制造飞机部件 B、还原铁粉可用作食品干燥剂 C、氯气、臭氧、二氧化氯都可用于饮用水的消毒 D、油脂是热值最高的营养物质9. 下列说法正确的是( )A、铁与碘反应易生成碘化铁 B、电解ZnSO4溶液可以得到Zn C、用石灰沉淀富镁海水中的Mg2+ , 生成碳酸镁 D、SO2通入BaCl2溶液中生成BaSO3沉淀10. 关于反应4CO2+SiH44CO+2H2O+SiO2 , 下列说法正确的是( )A、CO是氧化产物 B、SiH4发生还原反应 C、氧化剂与还原剂的物质的量之比为1∶4 D、生成1molSiO2时,转移8mol电子11. 下列说法不正确的是( )A、灼烧法做“海带中碘元素的分离及检验”实验时,须将海带进行灰化 B、用纸层析法分离铁离子和铜离子时,不能将滤纸条上的试样点浸入展开剂中 C、将盛有苯酚与水形成的浊液的试管浸泡在80℃热水中一段时间,浊液变澄清 D、不能将实验室用剩的金属钠块放回原试剂瓶12. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA B、1.8g重水(D2O)中所含质子数为NA C、足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA D、32g甲醇的分子中含有C—H键的数目为4NA13. 下列实验对应的离子方程式不正确的是( )A、将碳酸氢钙溶液与过量的澄清石灰水混合: +Ca2++OH-=CaCO3↓+H2O B、将少量NO2通入NaOH溶液:2NO2+2OH-= + +H2O C、将少量SO2通入NaClO溶液:SO2+H2O+2ClO-= +2HClO D、向氨水中滴入少量硝酸银溶液:Ag++2NH3·H2O= +2H2O14. 下列说法正确的是( )A、苯酚、乙醇、硫酸铜、氢氧化钠和硫酸铵均能使蛋白质变性 B、通过石油的常压分馏可获得石蜡等馏分,常压分馏过程为物理变化 C、在分子筛固体酸催化下,苯与乙烯发生取代反应获得苯乙烯 D、含氮量高的硝化纤维可作烈性炸药15. 关于化合物
6. 下列说法不正确的是( )A、液化石油气是纯净物 B、工业酒精中往往含有甲醇 C、福尔马林是甲醛的水溶液 D、许多水果和花卉有芳香气味是因为含有酯7. 下列说法不正确的是( )A、32S和34S互为同位素 B、C70和纳米碳管互为同素异形体 C、CH2ClCH2Cl和CH3CHCl2互为同分异构体 D、C3H6和C4H8一定互为同系物8. 下列说法不正确的是( )A、镁合金密度较小、强度较大,可用于制造飞机部件 B、还原铁粉可用作食品干燥剂 C、氯气、臭氧、二氧化氯都可用于饮用水的消毒 D、油脂是热值最高的营养物质9. 下列说法正确的是( )A、铁与碘反应易生成碘化铁 B、电解ZnSO4溶液可以得到Zn C、用石灰沉淀富镁海水中的Mg2+ , 生成碳酸镁 D、SO2通入BaCl2溶液中生成BaSO3沉淀10. 关于反应4CO2+SiH44CO+2H2O+SiO2 , 下列说法正确的是( )A、CO是氧化产物 B、SiH4发生还原反应 C、氧化剂与还原剂的物质的量之比为1∶4 D、生成1molSiO2时,转移8mol电子11. 下列说法不正确的是( )A、灼烧法做“海带中碘元素的分离及检验”实验时,须将海带进行灰化 B、用纸层析法分离铁离子和铜离子时,不能将滤纸条上的试样点浸入展开剂中 C、将盛有苯酚与水形成的浊液的试管浸泡在80℃热水中一段时间,浊液变澄清 D、不能将实验室用剩的金属钠块放回原试剂瓶12. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA B、1.8g重水(D2O)中所含质子数为NA C、足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA D、32g甲醇的分子中含有C—H键的数目为4NA13. 下列实验对应的离子方程式不正确的是( )A、将碳酸氢钙溶液与过量的澄清石灰水混合: +Ca2++OH-=CaCO3↓+H2O B、将少量NO2通入NaOH溶液:2NO2+2OH-= + +H2O C、将少量SO2通入NaClO溶液:SO2+H2O+2ClO-= +2HClO D、向氨水中滴入少量硝酸银溶液:Ag++2NH3·H2O= +2H2O14. 下列说法正确的是( )A、苯酚、乙醇、硫酸铜、氢氧化钠和硫酸铵均能使蛋白质变性 B、通过石油的常压分馏可获得石蜡等馏分,常压分馏过程为物理变化 C、在分子筛固体酸催化下,苯与乙烯发生取代反应获得苯乙烯 D、含氮量高的硝化纤维可作烈性炸药15. 关于化合物 ,下列说法正确的是( ) A、分子中至少有7个碳原子共直线 B、分子中含有1个手性碳原子 C、与酸或碱溶液反应都可生成盐 D、不能使酸性KMnO4稀溶液褪色16. W、X、Y、Z为原子序数依次增大的短周期主族元素。W和Y同族,Y的原子序数是W的2倍,X是地壳中含量最多的金属元素。下列说法正确的是( )A、非金属性:Y>W B、XZ3是离子化合物 C、Y、Z的氧化物对应的水化物均为强酸 D、X与Y可形成化合物X2Y317. 已知25℃时二元酸H2A的Ka1=1.3×10-7 , Ka2=7.1×10-15。下列说法正确的是( )A、在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者 B、向0.1mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013% C、向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-) D、取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+118. 相关有机物分别与氢气发生加成反应生成1mol环己烷(
,下列说法正确的是( ) A、分子中至少有7个碳原子共直线 B、分子中含有1个手性碳原子 C、与酸或碱溶液反应都可生成盐 D、不能使酸性KMnO4稀溶液褪色16. W、X、Y、Z为原子序数依次增大的短周期主族元素。W和Y同族,Y的原子序数是W的2倍,X是地壳中含量最多的金属元素。下列说法正确的是( )A、非金属性:Y>W B、XZ3是离子化合物 C、Y、Z的氧化物对应的水化物均为强酸 D、X与Y可形成化合物X2Y317. 已知25℃时二元酸H2A的Ka1=1.3×10-7 , Ka2=7.1×10-15。下列说法正确的是( )A、在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者 B、向0.1mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013% C、向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-) D、取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+118. 相关有机物分别与氢气发生加成反应生成1mol环己烷( )的能量变化如图所示:
)的能量变化如图所示:
下列推理不正确的是( )
A、2ΔH1≈ΔH2 , 说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比 B、ΔH2<ΔH3 , 说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定 C、3ΔH1<ΔH4 , 说明苯分子中不存在三个完全独立的碳碳双键 D、ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性19. 在恒温恒容条件下,发生反应A(s)+2B(g)3X(g),c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是( ) A、从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率 B、从b点切线的斜率可求得该化学反应在反应开始时的瞬时速率 C、在不同时刻都存在关系:2v(B)=3v(X) D、维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,c(B)随时间变化关系如图中曲线乙所示20. AB型强电解质在水中的溶解(可视作特殊的化学反应)表示为AB(s)=An+(aq)+Bn-(aq),其焓变和熵变分别为ΔH和ΔS。对于不同组成的AB型强电解质,下列说法正确的是( )A、ΔH和ΔS均大于零 B、ΔH和ΔS均小于零 C、ΔH可能大于零或小于零,ΔS大于零 D、ΔH和ΔS均可能大于零或小于零21. pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag—AgCl电极)和另一Ag—AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是( )
A、从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率 B、从b点切线的斜率可求得该化学反应在反应开始时的瞬时速率 C、在不同时刻都存在关系:2v(B)=3v(X) D、维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,c(B)随时间变化关系如图中曲线乙所示20. AB型强电解质在水中的溶解(可视作特殊的化学反应)表示为AB(s)=An+(aq)+Bn-(aq),其焓变和熵变分别为ΔH和ΔS。对于不同组成的AB型强电解质,下列说法正确的是( )A、ΔH和ΔS均大于零 B、ΔH和ΔS均小于零 C、ΔH可能大于零或小于零,ΔS大于零 D、ΔH和ΔS均可能大于零或小于零21. pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag—AgCl电极)和另一Ag—AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是( )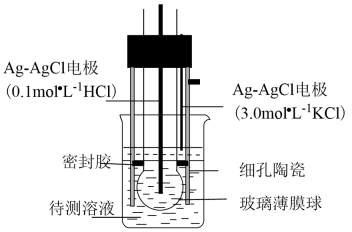 A、如果玻璃薄膜球内电极的电势低,则该电极反应式为:AgCl(s)+e-=Ag(s)+Cl(0.1mol·L-1) B、玻璃膜内外氢离子浓度的差异不会引起电动势的变化 C、分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH D、pH计工作时,电能转化为化学能22. 下列推测不合理的是( )A、相同条件下,Br2与PBr3反应比Cl2与PCl3反应难 B、OPBrCl2与足量H2O作用生成2种酸 C、相同条件下,与水反应由快到慢的顺序:OPBr3、OPCl3、OPF3 D、PBr3与足量C2H5OH作用可得到P(OC2H5)323. 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
A、如果玻璃薄膜球内电极的电势低,则该电极反应式为:AgCl(s)+e-=Ag(s)+Cl(0.1mol·L-1) B、玻璃膜内外氢离子浓度的差异不会引起电动势的变化 C、分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH D、pH计工作时,电能转化为化学能22. 下列推测不合理的是( )A、相同条件下,Br2与PBr3反应比Cl2与PCl3反应难 B、OPBrCl2与足量H2O作用生成2种酸 C、相同条件下,与水反应由快到慢的顺序:OPBr3、OPCl3、OPF3 D、PBr3与足量C2H5OH作用可得到P(OC2H5)323. 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
下列说法正确的的是( )
A、图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸 B、当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为:HCO+H+=CO2↑+H2O C、根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点 D、Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO)=c(OH-)-c(H+)24. 某课题组设计一种固定CO2的方法。下列说法不正确的是( ) A、反应原料中的原子100%转化为产物 B、该过程在化合物X和I-催化下完成 C、该过程仅涉及加成反应 D、若原料用
A、反应原料中的原子100%转化为产物 B、该过程在化合物X和I-催化下完成 C、该过程仅涉及加成反应 D、若原料用 , 则产物为
, 则产物为 25. 下列方案设计、现象和结论有不正确的是( )
25. 下列方案设计、现象和结论有不正确的是( )目的
方案设计
现象和结论
A
检验硫酸厂周边空气中是否含有二氧化硫
用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,观察溶液颜色变化
溶液不变色,说明空气中不含二氧化硫
B
鉴定某涂改液中是否存在含氯化合物
取涂改液与KOH溶液混合加热充分反应,取上层清液,硝酸酸化,加入硝酸银溶液,观察现象
出现白色沉淀,说明涂改液中存在含氯化合物
C
检验牙膏中是否含有甘油
将适量牙膏样品与蒸馏水混合,搅拌,静置一段时间,取上层清液,加入新制的Cu(OH)2 , 振荡,观察现象
溶液出现绛蓝色,说明牙膏中含有甘油
D
鉴别食盐与亚硝酸钠
各取少量固体加水溶解,分别滴加含淀粉的KI溶液,振荡,观察溶液颜色变化
溶液变蓝色的为亚硝酸钠;溶液不变蓝的为食盐
A、A B、B C、C D、D二、非选择题
-
26. 回答下列问题:(1)、两种有机物的相关数据如表:
物质
HCON(CH3)2
HCONH2
相对分子质量
73
45
沸点/℃
153
220
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是。
(2)、四种晶体的熔点数据如表:物质
CF4
SiF4
BF3
AlF3
熔点/℃
-183
-90
-127
>1000
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是。
27. 某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06g;残留的固体产物是Al2O3 , 质量为1.02g。计算:(1)、x=(写出计算过程)。(2)、气体产物中n(O2)mol。28. 化合物X由4种元素组成。某兴趣小组按如图流程进行实验: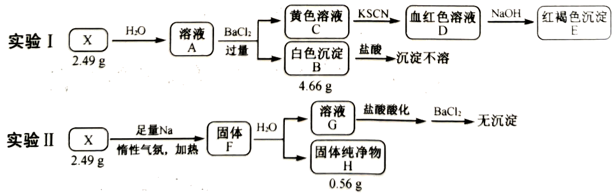
请回答:
(1)、组成X的元素有 , X的化学式为。(2)、溶液C中溶质的成分是(用化学式表示);根据C→D→E的现象,给出相应微粒与阳离子结合由弱到强的排序。(3)、X与足量Na反应生成固体F的化学方程式是。(4)、设计实验确定溶液G中阴离子。29. 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:(1)、在C和O2的反应体系中:反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是。
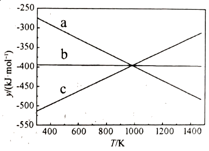
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比。
A.不变 B.增大 C.减小 D.无法判断
(2)、水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131kJ·mol-1。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是。(3)、一氧化碳变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1。①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
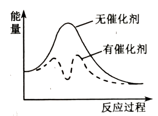
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:;步骤Ⅱ:。
30. 某兴趣小组用四水醋酸锰[(CH3COO)2Mn·4H2O]和乙酰氯(CH3COCl)为原料制备无水二氯化锰,按如图流程开展了实验(夹持仪器已省略):

已知:①无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸,不溶于苯。
②制备无水二氯化锰的主要反应:(CH3COO)2Mn+CH3COClMnCl2↓+2(CH3COO)2O。
③乙酰氯遇水发生反应:CH3COCl+H2O→CH3COOH+HCl。
请回答:
(1)、步骤Ⅰ:所获固体主要成分是(用化学式表示)。(2)、步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,目的分别是。(3)、步骤Ⅲ:下列操作中正确的是____。A、用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上 B、用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀 C、用乙醇作为洗涤剂,在洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物 D、洗涤结束后,将固体迅速转移至圆底烧瓶进行后续操作(4)、步骤Ⅳ:①奖装有粗产品的圆底烧瓶接到纯化装置(图2)上,打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化。请给出纯化完成后的操作排序:。纯化完成→( )→( )→( )→( )→将产品转至干燥器中保存
a.拔出圆底烧瓶的瓶塞
b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温
d.打开安全瓶上旋塞
②图2装置中U形管内NaOH固体的作用是。
(5)、用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通过测定产品中氯元素的含量确定纯度。合理的是(填“甲”或“乙”)同学的方法。三、有机推断题
-
31. 化合物H是一种具有多种生物活性的天然化合物。某课题组设计的合成路线如图(部分反应条件已省略):
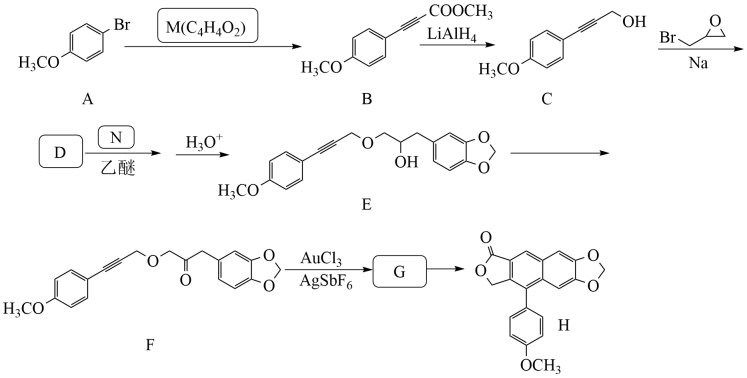
已知:R1BrR1MgBr
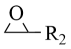

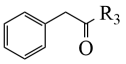 +
+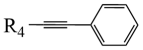
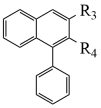 (1)、下列说法不正确的是____。A、化合物A不易与NaOH溶液反应 B、化合物E和F可通过红外光谱区别 C、化合物F属于酯类物质 D、化合物H的分子式是C20H12O5(2)、化合物M的结构简式是;化合物N的结构简式是;化合物G的结构简式是。(3)、补充完整C→D的化学方程式:2
(1)、下列说法不正确的是____。A、化合物A不易与NaOH溶液反应 B、化合物E和F可通过红外光谱区别 C、化合物F属于酯类物质 D、化合物H的分子式是C20H12O5(2)、化合物M的结构简式是;化合物N的结构简式是;化合物G的结构简式是。(3)、补充完整C→D的化学方程式:2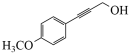 +2
+2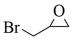 +2Na→。 (4)、写出2种同时符合下列条件的化合物B的同分异构体的结构简式(不包括立体异构体)。
+2Na→。 (4)、写出2种同时符合下列条件的化合物B的同分异构体的结构简式(不包括立体异构体)。①有两个六元环(不含其他环结构),其中一个为苯环;
②除苯环外,结构中只含2种不同的氢;
③不含—O—O—键及—OH
(5)、以化合物苯乙炔(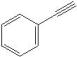 )、溴苯和环氧乙烷(
)、溴苯和环氧乙烷( )为原料,设计如图所示化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)。
)为原料,设计如图所示化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)。