云南省曲靖市2022届高三下学期第二次教学质量监测理科综合化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 2022年2月,第24届冬奥会在北京成功举办。下列有关说法正确的是( )A、为保证食物的口感和安全性,不能在食品中添加任何食品添加剂 B、北京冬奥会上,礼仪服饰采用高科技石墨烯发热材料,石墨烯属于有机高分子材料 C、冰的密度比水小,是因为水分子内存在氢键 D、“绿色奥运”是本届奥运会的理念之一,采用风能和太阳能为奥运服务体现了这一理念2. 若NA代表阿伏加德罗常数的值,下列说法正确的是( )A、常温下,18gH2O所含的质子数为18NA B、在标准状况下,5.6LCH4和11.2LCl2在光照下充分反应后的分子数为0.75NA C、1L0.1mol·L-1乙二酸溶液中含H+的数目为0.2NA D、用惰性电极电解饱和食盐水,电子转移的数目为NA时,生成的OH-浓度为1mol·L-13. 下列实验操作可以达到实验目的的是( )
选项
实验目的
实验操作
A
制备无水AlCl3
蒸发Al和稀盐酸反应后的溶液
B
验证结合H+的能力:CO<AlO
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀
C
验证可溶性MR为强酸强碱盐
25℃,测得MR溶液的pH=7
D
探究浓度对反应速率的影响
向2支各盛有5mL不同浓度的NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象
A、A B、B C、C D、D4. 科学家在提取中药桑白皮中的活性物质方面取得重大进展,其中一种活性物质的结构如图所示,下列说法错误的是( ) A、该物质核磁共振氢谱有9组吸收峰 B、该物质能使酸性高锰酸钾溶液褪色 C、1mol该物质最多能与5molNaOH反应 D、该物质的分子式为C19H18BrO45. 一种新型漂白剂由短周期元素W、X、Y、Z组成,其结构如图所示,其中W、Y、Z三种元素分别位于不同的短周期且不同主族,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子层结构相同。下列叙述错误的是( )
A、该物质核磁共振氢谱有9组吸收峰 B、该物质能使酸性高锰酸钾溶液褪色 C、1mol该物质最多能与5molNaOH反应 D、该物质的分子式为C19H18BrO45. 一种新型漂白剂由短周期元素W、X、Y、Z组成,其结构如图所示,其中W、Y、Z三种元素分别位于不同的短周期且不同主族,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子层结构相同。下列叙述错误的是( ) A、元素的非金属性X>Y B、该漂白剂的漂白原理与漂白粉相似 C、工业上通常采用电解W的氯化物的水溶液制备单质W D、该漂白剂中X、Y原子最外层均满足8电子稳定结构6. 科学家设计了一种高效、低能耗制备H2O2的装置,装置如图所示。下列有关说法错误的是( )
A、元素的非金属性X>Y B、该漂白剂的漂白原理与漂白粉相似 C、工业上通常采用电解W的氯化物的水溶液制备单质W D、该漂白剂中X、Y原子最外层均满足8电子稳定结构6. 科学家设计了一种高效、低能耗制备H2O2的装置,装置如图所示。下列有关说法错误的是( ) A、阴极区产生2molOH-时,参加反应的O2在标准状况下的体积为11.2L B、a为电源的正极 C、阳极区反应为
A、阴极区产生2molOH-时,参加反应的O2在标准状况下的体积为11.2L B、a为电源的正极 C、阳极区反应为 −2e-+3OH-=2H2O+
−2e-+3OH-=2H2O+ D、该装置中,离子交换膜为阴离子交换膜
7. 常温下,用0.10mol·L-1的盐酸滴定20mL相同浓度的某一元碱BOH溶液,滴定过程中pH及电导率变化曲线如图所示:
D、该装置中,离子交换膜为阴离子交换膜
7. 常温下,用0.10mol·L-1的盐酸滴定20mL相同浓度的某一元碱BOH溶液,滴定过程中pH及电导率变化曲线如图所示:
下列说法错误的是( )
A、BOH的Kb约为1×10-5 B、a点:c(B+)+2c(H+)=2c(OH-)+c(BOH) C、滴加盐酸的过程中,溶液中水的电离程度先减小后增大 D、b点:c(B+)<0.05mol·L-1二、综合题
-
8. 硫氰化钾(KSCN)是一种用途广泛的化学药品,常用于检验铁离子、银离子等。某化学兴趣小组制备硫氰化钾的简易实验装置如图所示(三颈烧瓶内盛放CS2、水和催化剂):
 (1)、NH4SCN的制备:关闭k2 , 打开k1 , 向三颈烧瓶中CS2层通入NH3并水浴加热制取NH4SCN,同时生成一种酸式盐,写出该反应的化学方程式 , 该反应(填“是”或“不是”)氧化还原反应。(2)、KSCN溶液的制备:关闭k1 , 保持三颈烧瓶内液体温度105℃一段时间以使酸式盐杂质分解除去,打开k2 , 缓缓滴入适量的KOH溶液制备KSCN溶液,该过程的加热方式为。(3)、尾气处理:烧杯中酸性K2Cr2O7溶液用于除去尾气中两种污染性气体,其中一种气体A能使酚酞试液变红,另一种气体B能使酸性K2Cr2O7溶液颜色变浅(含Cr3+),且产生浅黄色沉淀,写出除去杂质气体B的离子方程式。(4)、KSCN晶体的制备:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶、、、干燥,得到KSCN晶体。(5)、测定晶体中KSCN的含量:称取7.0g样品配成500mL溶液,量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol·L-1AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液24.00mL。
(1)、NH4SCN的制备:关闭k2 , 打开k1 , 向三颈烧瓶中CS2层通入NH3并水浴加热制取NH4SCN,同时生成一种酸式盐,写出该反应的化学方程式 , 该反应(填“是”或“不是”)氧化还原反应。(2)、KSCN溶液的制备:关闭k1 , 保持三颈烧瓶内液体温度105℃一段时间以使酸式盐杂质分解除去,打开k2 , 缓缓滴入适量的KOH溶液制备KSCN溶液,该过程的加热方式为。(3)、尾气处理:烧杯中酸性K2Cr2O7溶液用于除去尾气中两种污染性气体,其中一种气体A能使酚酞试液变红,另一种气体B能使酸性K2Cr2O7溶液颜色变浅(含Cr3+),且产生浅黄色沉淀,写出除去杂质气体B的离子方程式。(4)、KSCN晶体的制备:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶、、、干燥,得到KSCN晶体。(5)、测定晶体中KSCN的含量:称取7.0g样品配成500mL溶液,量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol·L-1AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液24.00mL。①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),则滴定终点的现象是。
②晶体中KSCN的质量分数为(保留三位有效数字)
9. 五氟化锑主要用作氟化工的催化剂,也用作纺织工业织物阻燃剂,在染料工业中用于制造染料中间体,此外,还用于制备高纯度金属锑、无机离子交换材料和胶体五氧化二锑。以某锑矿(主要成分为Sb2O3 , 含有少量CuO、PbO、As2O3等杂质)为原料制备SbF5的工艺流程如图1:
已知:I.CuS、PbS的Ksp分别为6.3×10-36、9.0×10-29;
II.As2O3微溶于水、Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
回答下列问题:
(1)、已知锑与氮元同素主族,原子序数为51,请写出锑在元素周期表中的位置。(2)、“浸出”时少量Sb2O3转化为“滤渣1”。其成分为SbOCl,加入氨水“除氯”,同时将其转化为Sb2O3 , 该反应的离子方程式为 , 不宜用NaOH溶液代替氨水的原因为。(3)、“沉淀”的过程是加入极稀的Na2S溶液,其目的是使Cu2+和Pb2+转化为相应的硫化物而除去,当CuS、PbS共沉时,=。(4)、“除砷”时,H2PO转化为H3PO4 , 该反应中氧化剂与还原剂的物质的量之比为。(5)、“电解”中锑的产率与电压大小关系如图2所示。当电压趣过U0V时,锑的产率降低的原因可能是。 (6)、SbF5与KMnF6反应。首次实现了用化学方法制取F2 , 同时生成KSbF6和MnF3 , 化学反应方程式为。10. 在机动车发动机中,燃料燃烧产生的高温会使空气中的氮气和氧气反应,生成氮氧化物,某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
(6)、SbF5与KMnF6反应。首次实现了用化学方法制取F2 , 同时生成KSbF6和MnF3 , 化学反应方程式为。10. 在机动车发动机中,燃料燃烧产生的高温会使空气中的氮气和氧气反应,生成氮氧化物,某些硝酸盐分解,也会产生氮氧化物,已知如下反应:①2AgNO3(s)=2Ag(s)+2NO2(g)+O2(g) △H1>0
②2NO2(g)N2O4(g) △H2<0
(1)、温度T1时,在0.5L的恒容密闭容器中投入0.04molAgNO3(s)并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图1所示:
①下列情况能说明体系达到平衡状态的是(填字母)。
a.混合气体的平均相对分子质量不再改变
b.O2的浓度不再改变
c.NO2的体积分数不再改变
d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强p=0.8MPa,反应开始到10min内N2O4的平均反应速率为MPa·min-1。在该温度下2NO2(g)N2O4(g)的平衡常数Kp=(MPa)-1(结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
③实验测得正=(NO2)消耗=k正c2(NO2),逆=2(N2O4)消耗=k逆c(N2O4),k正、k逆为速率常数且只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=。若将容器的温度改变为T2时,其k正=10k逆 , 则T1T2(填“>”“<”或“=”)。
(2)、用活性炭还原法可将氮氧化物转化为无毒气体,有关反应为C(s)+2NO(g)N2(g)+CO2(g)。向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入NO和N2 , 使二者的浓度均增加至原来的两倍,此时反应正 逆(填“>”“<”或“=”)。(3)、氮氧化物排放到空气中会造成空气污染。2021年我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种Zn—NO电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图2所示(双极膜可将水解离为H+和OH- , 并实现其定向通过)。在该电池工作过程中,MoS2电极上发生的电极反应式为 , 若有4.48LNO(标准状况下)参加反应,Zn/ZnO电极质量增加g。 11. 云南省曲靖市物华天宝,资源丰富,煤炭、磷、铅、锌、锑等资源储量位居全省前列,会泽县“斑铜”技艺更是闻名全国。2021年12月,中国有色金属工业协会授予曲靖市“绿色晶硅光伏之都”称号。(1)、晶体硅中Si原子的杂化方式是 , 基态Zn原子核外电子排布式为 , 基态Cu原子核外有种能量不同的电子。(2)、磷化亚铜(Cu3P)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化亚铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为;Si、P、S的第一电离能(I1)由大到小的顺序为。(3)、一种铜金合金具有储氢功能。其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为。该储氢材料储氢时,氢分子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图1),该晶体储氢后的化学式为。
11. 云南省曲靖市物华天宝,资源丰富,煤炭、磷、铅、锌、锑等资源储量位居全省前列,会泽县“斑铜”技艺更是闻名全国。2021年12月,中国有色金属工业协会授予曲靖市“绿色晶硅光伏之都”称号。(1)、晶体硅中Si原子的杂化方式是 , 基态Zn原子核外电子排布式为 , 基态Cu原子核外有种能量不同的电子。(2)、磷化亚铜(Cu3P)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化亚铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为;Si、P、S的第一电离能(I1)由大到小的顺序为。(3)、一种铜金合金具有储氢功能。其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为。该储氢材料储氢时,氢分子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图1),该晶体储氢后的化学式为。 (4)、磷青铜晶体的晶胞结构如图2所示,该晶体中P原子位于由铜原子形成的的空隙中。若晶体密度为ag·cm-3 , P与最近的Cu原子的核间距为nm(用含NA的代数式表示)。
(4)、磷青铜晶体的晶胞结构如图2所示,该晶体中P原子位于由铜原子形成的的空隙中。若晶体密度为ag·cm-3 , P与最近的Cu原子的核间距为nm(用含NA的代数式表示)。 12. 用于治疗高血压的药物Q的合成路线如图:
12. 用于治疗高血压的药物Q的合成路线如图:
已知:芳香族化合物与卤代烃在AlCl3催化下可发生如下可逆反应:
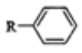 +R′Cl
+R′Cl +HCl(1)、W的一氯代物只有一种,则W的名称为。(2)、B→D的化学方程式。(3)、F的结构简式为
+HCl(1)、W的一氯代物只有一种,则W的名称为。(2)、B→D的化学方程式。(3)、F的结构简式为 , 的反应类型是。 (4)、M的结构简式是。(5)、生成L的反应为取代反应且L中不含苯环之外的其他环状结构,L分子中所含的官能团有碳氯键(氯原子)、酰胺基、、。(6)、满足下列条件的D的同分异构体有种。
, 的反应类型是。 (4)、M的结构简式是。(5)、生成L的反应为取代反应且L中不含苯环之外的其他环状结构,L分子中所含的官能团有碳氯键(氯原子)、酰胺基、、。(6)、满足下列条件的D的同分异构体有种。①含有酯基;②能发生银镜反应。
其中,核磁共振氢谱显示三组蜂的物质的结构简式为。(任写一种)
(7)、H2NCH2CH2NH2的同系物 (丙二胺)可用于合成药物。
(丙二胺)可用于合成药物。已知:i.R1HC=CHR2R1CHO+R2CHO
ii.ROH+NH3RNH2+H2O
iii.RCN+2H2RCH2NH2
如图方法能合成丙二胺,中间产物X、Y、Z的结构简式分别是、、。
CH3CH=CHCH3→→→→
