新疆维吾尔自治区2022届高三下学期第三次适应性检测理科综合化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 下列与化学有关的文献,理解错误的是( )A、《咏石灰》(明·于谦)中“烈火焚烧若等闲,要留清白在人间”,其中“清白”是指氢氧化钙 B、《咏煤炭》(明·于谦)中“凿开混沌得乌金,不辞辛苦出山林”,其中“乌金”的主要成分是煤炭 C、《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的矾一般指时是金属硫酸盐 D、《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质”,文中的“裘”主要成分是蛋白质2. 下列反应的离子方程式错误的是( )A、向饱和氯化钠溶液中依次通入足量NH3和CO2:Na++NH3+CO2+H2O=NaHCO3↓+NH B、电解CuSO4溶液的总反应(石墨作阳极、铁作阴极):2Cu2++2H2O2Cu+4H++O2↑ C、FeO与稀硝酸的反应:3FeO+10H++NO=3Fe3++NO↑+5H2O D、硫酸氢钠溶液中滴加过量的氢氧化钡溶液:2H++SO+Ba2++2OH-=BaSO4↓+2H2O3. 前列腺素是存在于动物和人体中的具有多种生理活性的物质,一种前列腺素的结构简式如图所示,下列有关该化合物的叙述中正确的是( )
 A、分子式为 B、能发生加聚反应,不能发生缩聚反应 C、1mol该化合物最多消耗5mol D、含有多种属于芳香族的同分异构体4. 20世纪80年代Townley首次提出利用电化学膜脱除烟气中SO2:将烟气预氧化使SO2转化为SO3 , 再将预氧化后的烟气利用如图所示原理进行净化。下列说法正确的是( )
A、分子式为 B、能发生加聚反应,不能发生缩聚反应 C、1mol该化合物最多消耗5mol D、含有多种属于芳香族的同分异构体4. 20世纪80年代Townley首次提出利用电化学膜脱除烟气中SO2:将烟气预氧化使SO2转化为SO3 , 再将预氧化后的烟气利用如图所示原理进行净化。下列说法正确的是( ) A、预氧化时,可以用酸性KMnO4溶液来氧化SO2 B、阳极的电极反应式:2SO-4e-=2SO3↑+O2↑ C、电解过程中,硫酸根离子的物质的量在不断减少 D、工业上一般用蒸馏水吸收“扫出气”,得到的产物保存在棕色广口瓶中5. Ni可活化C2H6制得CH4 , 其反应历程如图所示:
A、预氧化时,可以用酸性KMnO4溶液来氧化SO2 B、阳极的电极反应式:2SO-4e-=2SO3↑+O2↑ C、电解过程中,硫酸根离子的物质的量在不断减少 D、工业上一般用蒸馏水吸收“扫出气”,得到的产物保存在棕色广口瓶中5. Ni可活化C2H6制得CH4 , 其反应历程如图所示:
下列关于活化历程的说法正确的是( )
A、中间体2→中间体3的活化能小于中间体1→中间体2 B、Ni在该反应中作催化剂 C、可以用焓判据来判断该反应是否自发进行 D、Ni(s)+C2H6(g)=NiCH2(s)+CH4(g) ΔH=+6.57kJ·mol-16. 为减轻环境污染,提高资源的利用率,可将钛厂、氯碱厂和甲醇厂联合进行生产。生产工艺流程如下:
已知:“氯化”过程在高温下进行,且该过程中元素的化合价没有变化。下列叙述错误的是( )
A、中为+4价 B、“合成”过程中原子利用率为 C、“氯化”时发生反应的化学方程式为 D、上述流程中生成钛时可用代替7. 常温下,某研究小组用数字传感器探究AgSCN的沉淀溶解平衡(AgSCN是白色沉淀)。实验测得悬浊液中溶解的SCN-浓度变化如图所示,其中a点表示AgSCN溶于KNO3溶液形成的悬浊液。下列说法错误的是( )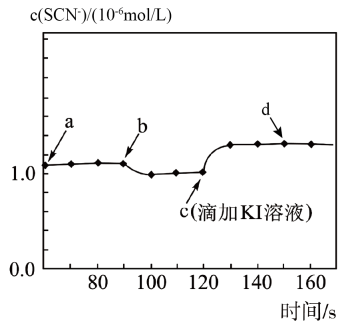 A、图中b点可能是加少量水稀释了 B、图中c点后有黄色沉淀生成 C、图中d点c(Ag+)<c(SCN-) D、由图可知:Ksp(AgI)<Ksp(AgSCN)
A、图中b点可能是加少量水稀释了 B、图中c点后有黄色沉淀生成 C、图中d点c(Ag+)<c(SCN-) D、由图可知:Ksp(AgI)<Ksp(AgSCN)二、综合题
-
8. 为测定某氟化稀土样品中氟元素的质量分数,进行如图实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再进行吸收滴定来测定含量。实验装置如图所示。
 (1)、装置d的名称是。玻璃管a的作用为。(2)、实验步骤:①连接好实验装置,检查装置气密性;②往c中加入mg氟化稀土样品和一定体积的高氯酸,f中盛有滴加酚酞的NaOH溶液。加热装置b、c。
(1)、装置d的名称是。玻璃管a的作用为。(2)、实验步骤:①连接好实验装置,检查装置气密性;②往c中加入mg氟化稀土样品和一定体积的高氯酸,f中盛有滴加酚酞的NaOH溶液。加热装置b、c。①下列物质可代替高氯酸的是(填序号)。
A.硫酸 B.盐酸 C.硝酸 D.磷酸
②装置b中产生的水蒸气的作用是。
(3)、定量测定:将f中得到的馏出液配成100mL溶液,取其中20mL加入V1mLamol·L-1La(NO3)3溶液,得到LaF3沉淀(不考虑其他沉淀的生成),再用bmol·L-1冠醚标准溶液滴定剩余La3+(La3+与冠醚按1:1配合),消耗冠醚标准溶液V2mL,则氟化稀土样品中氟的质量分数为。(4)、问题讨论:若观察到f中溶液红色褪去,可采用最简单的补救措施是。否则会使实验结果。实验中除有HF气体外,可能还有少量SiF4(极易水解)气体生成。若有SiF4生成,实验结果将。(填“偏高”“偏低”或“不受影响”)。理由是。9. 甲基叔丁基醚(MTBE)是一种高辛烷值汽油添加剂,可由甲醇和异丁烯(以IB表示)在催化剂作用下合成:CH3OH(g)+IB(g)MTBE(g) ∆H。回答下列问题:(1)、反应过程中反应物首先被催化剂吸附,再经历过渡态,最终得到产物,相对能量与反应历程的关系如图1所示(其中N1表示甲醇和异丁烯同时被吸附,N2表示甲醇先被吸附,N,表示异丁烯先被吸附),该反应的∆H=kJ·mol-1 , 下列说法错误的是。
A.过渡态1比另两种过渡态稳定
B.三种反应历程中,N3反应速率最快
C.降低温度和增大压强都有利于提高反应物平衡转化率
D.起始投料在刚性容器中分别采用三种途径反应相同时间,三种途径MTBE的产率一定相同
(2)、向刚性密闭容器中充入等物质的量的甲醇和异丁烯,在催化剂作用下,分别在T1和T2两个温度反应,异丁烯的转化率随时间的变化关系如图2所示。
①T2时,反应90min后到达点B,此时甲醇的体积分数为(保留3位有效数字)
②A、B、M三点中,正反应速率最大的是 , 逆反应速率最小的是。
③比较A、B、M三点的平衡常数K(A)、K(B)、K(M),从大到小的顺序是。
④已知对于反应dD(g)+eE(g)gG(g)+hH(g),标准平衡常数Kθ= , 其中PG、PH、PD、PE为各组分的平衡分压,分压=总压×该组分物质的量分数,pθ=100kPa。在T1时,将等物质的量的甲醇和异丁烯充入恒容密闭容器中(初始压强为200kPa),甲醇的平衡分压为 , 反应的标准平衡常数Kθ=。
10. 从铜转炉烟灰(主要成分ZnO还有Pb、Cu、Cd、As、Cl、F等元素)中回收锌、铜、铅等元素进行资源综合利用,具有重要意义。以铜转炉烟灰制备重要化工原料活性氧化锌的工艺流程如图所示。
已知:活性炭净化主要是除去有机杂质。
请回答以下问题:
(1)、若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为。(2)、在反应温度为50℃,反应时间为1h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图所示,结合流程图分析,氯化铵适宜的浓度为mol·L-1。 (3)、若浸出液中c(AsO)=6.0×10-3mol·L-1 , 现将8.0×10-3mol·L-1FeCl3溶液与浸出液等体积混合生成砷酸铁沉淀。若该温度时Ksp(FeAsO4)=2.0×10-22 , 则反应后溶液中c(AsO)=mol·L-1。(4)、滤渣II的主要成分为;除杂3主要除去的金属有(填化学式)。(5)、沉锌得到的物质为Zn(NH3)2Cl2 , 请写出水解转化的化学方程式。(6)、该流程中可以循环使用的物质的化学式为。(7)、将Pb(OH)Cl溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
(3)、若浸出液中c(AsO)=6.0×10-3mol·L-1 , 现将8.0×10-3mol·L-1FeCl3溶液与浸出液等体积混合生成砷酸铁沉淀。若该温度时Ksp(FeAsO4)=2.0×10-22 , 则反应后溶液中c(AsO)=mol·L-1。(4)、滤渣II的主要成分为;除杂3主要除去的金属有(填化学式)。(5)、沉锌得到的物质为Zn(NH3)2Cl2 , 请写出水解转化的化学方程式。(6)、该流程中可以循环使用的物质的化学式为。(7)、将Pb(OH)Cl溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
①写出电解时阴极的电极反应式。
②电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向阴极室加入(填化学式)。
11. 许多元素及它们的化合物在科学研究和工业生产中具有多种用途。请回答下列有关问题:(1)、现代化学中,常利用上的特征谱线来鉴定元素。(2)、某同学画出的基态碳原子的核外电子排布图为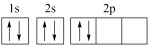 , 该电子排布图背了。CH、-CH3、CH都是重要的有机反应中间体。CH、CH的空间构型分别为、。 (3)、咪唑的结构为
, 该电子排布图背了。CH、-CH3、CH都是重要的有机反应中间体。CH、CH的空间构型分别为、。 (3)、咪唑的结构为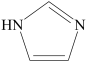 。分子中的大π键可用符号π表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π)。咪唑分子中的大π键可表示为 , 咪唑比环戊烯C5H8熔点高的主要原因是。 (4)、
。分子中的大π键可用符号π表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π)。咪唑分子中的大π键可表示为 , 咪唑比环戊烯C5H8熔点高的主要原因是。 (4)、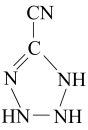 中孤电子对与π键比值为 , 碳原子的杂化方式为。 (5)、铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力。有望获得较高的微波磁导率,具有极大的市场潜力。其四子格结构如图所示,已知晶体密度为ρg·cm-3 , 阿伏加德罗常数为NA。
中孤电子对与π键比值为 , 碳原子的杂化方式为。 (5)、铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力。有望获得较高的微波磁导率,具有极大的市场潜力。其四子格结构如图所示,已知晶体密度为ρg·cm-3 , 阿伏加德罗常数为NA。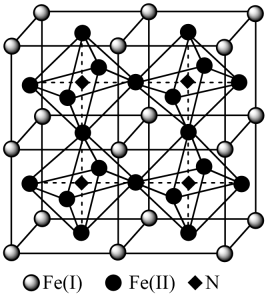
①写出氮化铁中铁的堆积方式为。
②该化合物的化学式为。
③计算出Fe(II)围成的八面体的体积为cm3。
12. 异戊巴比妥对中枢神经系统有抑制作用,主要用于催眠、镇静、抗惊厥以及麻醉前给药。合成路线如图:
回答下列问题:
(1)、A的名称是 , B所含官能团的名称为。(2)、C的结构简式为 , 异戊巴比妥的分子式为。(3)、A→B的化学方程式为 , B→C的反应类型是。(4)、M在分子组成上比B少1个—CH2—原子团,则M的同分异构体中是A的同系物的有种(不考虑立体异构),其中核磁共振氢谱有3种吸收峰,且峰面积之比为1:1:3的同分异构体的结构简式为。(5)、已知在同一位置引入烷基时,一般先引入大的基团以控制中间体的质量,请设计一种由A制备 的合成路线(试剂任选)。。
的合成路线(试剂任选)。。