天津市河西区2022届二模化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 下列物质变化过程中,涉及氧化还原反应的是( )A、粗盐提纯 B、海水提溴 C、油脂皂化 D、石油分馏2. 维生素的结构简式如图所示,下列有关它的说法错误的是( )
 A、分子中含有2个手性碳 B、一定条件下能发生缩聚反应 C、能与酸性溶液反应 D、分子中含有酰胺基、羧基和羟基三种官能团3. 在配制0.1000 NaOH标准溶液并用其滴定未知浓度盐酸的实验过程中,不需要用到的仪器是( )A、
A、分子中含有2个手性碳 B、一定条件下能发生缩聚反应 C、能与酸性溶液反应 D、分子中含有酰胺基、羧基和羟基三种官能团3. 在配制0.1000 NaOH标准溶液并用其滴定未知浓度盐酸的实验过程中,不需要用到的仪器是( )A、 B、
B、 C、
C、 D、
D、 4. 下列有关Na、Mg、Al的叙述正确的是( )A、元素均位于周期表s区 B、均可用电解法冶炼制得单质 C、原子均有一个未成对电子 D、还原性由弱到强:5. 下列有关物质的用途叙述错误的是( )A、氮气常用作保护气 B、液氨常用作制冷剂 C、氯化铵常用作氮肥 D、氨水常用作消毒剂6. 下列条件下,可以大量共存的离子组是( )A、透明溶液中:、、 B、pH=13的溶液中:、、 C、含有大量的溶液中:、、 D、含有大量的溶液:、、7. 下列化学用语表达正确的是( )A、基态硫原子的轨道表示式:
4. 下列有关Na、Mg、Al的叙述正确的是( )A、元素均位于周期表s区 B、均可用电解法冶炼制得单质 C、原子均有一个未成对电子 D、还原性由弱到强:5. 下列有关物质的用途叙述错误的是( )A、氮气常用作保护气 B、液氨常用作制冷剂 C、氯化铵常用作氮肥 D、氨水常用作消毒剂6. 下列条件下,可以大量共存的离子组是( )A、透明溶液中:、、 B、pH=13的溶液中:、、 C、含有大量的溶液中:、、 D、含有大量的溶液:、、7. 下列化学用语表达正确的是( )A、基态硫原子的轨道表示式: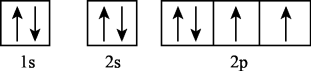 B、的电子式:
B、的电子式: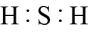 C、的VSEPR模型:
C、的VSEPR模型: D、的分子的空间结构模型
D、的分子的空间结构模型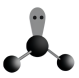 8. 我国传统酿醋工艺主要步骤有①“蒸”:将大米等原料蒸熟后放至冷却②“酵”:拌酶曲入坛发酵,经糖化、成醇,再在醋酸菌作用下成酸③“沥”;除糟,闻到酒、醋香味④“陈”:陈放1~3年,闻到果香味。下列有关叙述正确的是( )A、步骤①将大米蒸熟后产生大量葡萄糖 B、步骤②中涉及葡萄糖水解为乙醇的反应 C、步骤③用萃取法除去坛底的糟 D、步骤④乙醇和乙酸缓慢地发生酯化反应9. 一种碳化硅晶体的晶胞如图所示,与金刚石的类似。下列判断正确的是( )
8. 我国传统酿醋工艺主要步骤有①“蒸”:将大米等原料蒸熟后放至冷却②“酵”:拌酶曲入坛发酵,经糖化、成醇,再在醋酸菌作用下成酸③“沥”;除糟,闻到酒、醋香味④“陈”:陈放1~3年,闻到果香味。下列有关叙述正确的是( )A、步骤①将大米蒸熟后产生大量葡萄糖 B、步骤②中涉及葡萄糖水解为乙醇的反应 C、步骤③用萃取法除去坛底的糟 D、步骤④乙醇和乙酸缓慢地发生酯化反应9. 一种碳化硅晶体的晶胞如图所示,与金刚石的类似。下列判断正确的是( ) A、该晶体质软 B、熔点:碳化硅>金刚石 C、该晶体熔融时会破坏极性键 D、碳原子轨道的杂化类型为sp杂化10. 太阳能光伏电池电解水制高纯氢的工作示意图如下。下列相关叙述错误的是( )
A、该晶体质软 B、熔点:碳化硅>金刚石 C、该晶体熔融时会破坏极性键 D、碳原子轨道的杂化类型为sp杂化10. 太阳能光伏电池电解水制高纯氢的工作示意图如下。下列相关叙述错误的是( ) A、连接时电极1附近pH降低 B、连接时,溶液中的阴离子向电极2迁移 C、连接时电极3上NiO(OH)被还原为 D、交替连接、时,电极3附近的也会交替消耗和生成11. 向2L容密闭容器中投入一定量的CO和 , 发生如下反应: , CO的平衡转化率与温度、投料比[]的关系如下图所示。( )
A、连接时电极1附近pH降低 B、连接时,溶液中的阴离子向电极2迁移 C、连接时电极3上NiO(OH)被还原为 D、交替连接、时,电极3附近的也会交替消耗和生成11. 向2L容密闭容器中投入一定量的CO和 , 发生如下反应: , CO的平衡转化率与温度、投料比[]的关系如下图所示。( ) A、 B、投料比: C、在400K、条件下,反应Ⅰ的平衡常数的值为0.25 D、在500K、条件下,增大压强,CO的平衡转化率能从Y点到Z点12. 25℃时分别向体积均为10mL、浓度均为0.1mol/L的HA溶液、HB溶液中滴加0.1mol/L的NaOH溶液,两种溶液中由水电离的的负对数即[]与滴加[NaOH(aq)]的关系如图所示。
A、 B、投料比: C、在400K、条件下,反应Ⅰ的平衡常数的值为0.25 D、在500K、条件下,增大压强,CO的平衡转化率能从Y点到Z点12. 25℃时分别向体积均为10mL、浓度均为0.1mol/L的HA溶液、HB溶液中滴加0.1mol/L的NaOH溶液,两种溶液中由水电离的的负对数即[]与滴加[NaOH(aq)]的关系如图所示。
下列说法错误的是( )
A、HA为强酸 B、a、b两点溶液均呈中性 C、b、d两点溶液中 D、c点溶液中二、综合题
-
13. 硅及其化合物在生活生产中广泛应用。请按要求回答下列问题。(1)、基态硅原子的电子排布式为;Si原子间难形成双键而C原子间却可以形成,是因为Si的原子半径(填“大于”或“小于”)C的,两个Si原子的p电子难于重叠形成π键。(2)、工业上制备高纯硅的示意图如下:

①步骤Ⅰ反应所涉及元素的第一电离能由大到小的顺序是(填元素符号)。根据下图所示物质反应过程中的能量变化,写出用石英砂和焦炭制取粗硅,同时生成CO的热化学方程式:。

②步骤Ⅱ产物中含有(沸点为33.0℃),还有少量(沸点为57.6℃)和HCl(沸点为-84.7℃)。若先将步骤Ⅱ产物降至室温,提纯 , 方法是。所用到的玻璃仪器除酒精灯、温度计、锥形瓶、尾接管外,还需要、。
(3)、已知:硅的最高价氧化物对应的水化物有和原硅酸( )。常温下,:、;:、
)。常温下,:、;:、①向盛有饱和溶液(滴有酚酞溶液)的试管中通入过量;充分反应后,用激光笔照射上述液体时发现有光亮的通路。预测液体颜色的变化:;写出该反应的离子方程式:。
②写出原硅酸脱水得到的产物(写两种)、。
14. 药合成中间体M的合成路线如下图所示:
请按要求回答下列问题:
(1)、M分子所含官能团名称为。(2)、B的分子式为;C的结构简式为。(3)、E→F反应类型为。(4)、X( )是G的同分异构体,写出X与NaOH水溶液加热条件下反应的化学方程式:。 (5)、E的同分异构体有多种,其中符合下列所有条件的有(不含E、不考虑立体异构)种。
)是G的同分异构体,写出X与NaOH水溶液加热条件下反应的化学方程式:。 (5)、E的同分异构体有多种,其中符合下列所有条件的有(不含E、不考虑立体异构)种。ⅰ.苯环上有4个取代基,其中3个是羟基
ⅱ.苯环上仅有1种环境的氢
ⅲ.不含碳碳双键
写出其中核磁共振氢谱有6组峰的结构简式:。
(6)、写出以苯、 和必要的无机试剂为原料制备化合物
和必要的无机试剂为原料制备化合物 的合成路线。请参考题干合成路线及反应条件,在如下方框中写出其合成路线的流程图。
的合成路线。请参考题干合成路线及反应条件,在如下方框中写出其合成路线的流程图。 15. 某化学小组设计了如下有关氮的化合物的实验。请按要求回答下列问题。(1)、氨气的喷泉实验:如下图装置所示,干燥的圆底烧瓶里充满 , 欲观察到烧瓶中产生喷泉,需进行的操作是。
15. 某化学小组设计了如下有关氮的化合物的实验。请按要求回答下列问题。(1)、氨气的喷泉实验:如下图装置所示,干燥的圆底烧瓶里充满 , 欲观察到烧瓶中产生喷泉,需进行的操作是。 (2)、硝酸的制备实验:如图所示a~f装置。
(2)、硝酸的制备实验:如图所示a~f装置。
①装置a的最佳选择为(填“图3”或“图4”)。

②装置b中的作用是。
(3)、硝酸的性质实验:①常温下,同学甲在上图实验结束后,用pH计测装置e中溶液的pH=1.00。
ⅰ.这说明e中发生的反应可能为(写化学方程式)。
ⅱ.同学乙做同样实验,测得e中溶液的pH=6.00,可能原因是。
②用如图所示装置进行硝酸与铜的反应实验。

ⅰ.请在h方框中补全该实验所需装置图并标注所需试剂。
ⅱ.硝酸一般盛放在棕色试剂瓶中,请用化学方程式说明其原因:。
ⅲ.g中为稀硝酸时,反应开始后,g中溶液颜色变蓝。写出g中反应的离子方程式:。
ⅳ.g中为浓硝酸时,g中溶液颜色变绿。反应较ⅱ中剧烈许多的原因是。
ⅴ.对比ⅲ与ⅳ反应后g中溶液颜色,推测其原因是ⅳ反应后g溶液中溶有且达饱和。为证明该推测正确,向ⅳ反应后g溶液中加入 , 会观察到溶液颜色由绿色变为蓝色。
ⅵ.已知(aq)呈蓝色、(aq)呈黄色。取ⅰ中少量蓝色溶液于试管中,向其中滴加饱和NaCl溶液,观察到溶液颜色由蓝变为蓝绿色,再加热该混合溶液,溶液颜色逐渐变为黄绿色。结合离子反应方程式解释其原因:。
16. 除去废水中Cr(Ⅵ)的方法有多种。请按要求回答下列问题。(1)、金属除Cr(Ⅵ)法:其他条件相同时,用等量的Zn粉、Zn-Cu粉分别处理酸性含Cr(Ⅵ)废水。Cr(Ⅵ)的残留率随时间的变化如下图所示,图1中b方法选用的金属粉处理效果更快的原因是。 (2)、与熟石灰除Cr(Ⅵ)法:向酸性废水中加入 , 再加入熟石灰,使沉淀(常温下;设时沉淀完全)。
(2)、与熟石灰除Cr(Ⅵ)法:向酸性废水中加入 , 再加入熟石灰,使沉淀(常温下;设时沉淀完全)。①实验中的作用是。
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当pH>12时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为。

③为使沉淀完全,调控溶液的pH最小值为。
(3)、离子交换法除铬(Ⅵ):Cr(Ⅵ)去除率与pH关系如图所示。已知:强碱性树脂(ROH)与废水中的、离子能发生交换均生成(s)。其反应可表示为(以发生交换为例)。
①写出发生交换反应的平衡常数表达式,。
②当pH>4时,Cr(Ⅵ)去除率下降的原因是。
(4)、电解除铬(Ⅵ)法:一般采用在直流电作用下铁板做阳极和阴极[忽略Cr(Ⅵ)在阴极放电],可将酸性废水中的Cr(Ⅵ)转化为 , 再加碱沉淀为。已知:。①酸性废水中的Cr(Ⅵ)离子存在的主要形式为。
②当沉淀出2mol 时,阳极至少消耗mol Fe。