天津市河北区2022届高三下学期质量检测(二)化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 垃圾分类有利于资源回收利用。下列关于回收和垃圾分类说法错误的是( )A、废弃荧光灯管含有重金属,属于有害垃圾 B、厨余垃圾发酵后制成肥料,涉及氧化还原反应 C、废弃的聚乙烯塑料有毒不易降解,属于不可回收垃圾 D、废旧玻璃瓶主要成分是硅酸盐和二氧化硅,属于可回收垃圾2. 下列有关化学用语表示正确的是( )A、次氯酸的电子式:
 B、的结构示意图:
B、的结构示意图: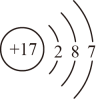 C、基态碳原子价层电子轨道表示式为:
C、基态碳原子价层电子轨道表示式为: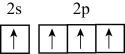 D、四氯化碳的空间填充模型:
D、四氯化碳的空间填充模型: 3. 下列说法正确的是( )A、分子形状呈三角锥形,是非极性分子 B、凡有规则外形的固体一定是晶体 C、电负性越大的元素,第一电离能也越大 D、分子中σ键与π键的数目之比是1:14. 化学在人类社会发展中发挥着重要作用,下列说法错误的是( )A、双氧水可用于处理泄漏的有毒物质 B、在钢铁设备上连接金属铜保护钢铁 C、高纯硅可用于制作通信设备的芯片 D、可用核磁共振氢谱区分苯甲醇和对甲基苯酚5. 下列叙述正确的是( )A、和互称为同素异形体 B、元素周期表中位于金属与非金属分界线附近的元素属于过渡元素 C、合成氨工业中采用循环操作,主要是为了提高氮气和氢气的利用率 D、聚乳酸(
3. 下列说法正确的是( )A、分子形状呈三角锥形,是非极性分子 B、凡有规则外形的固体一定是晶体 C、电负性越大的元素,第一电离能也越大 D、分子中σ键与π键的数目之比是1:14. 化学在人类社会发展中发挥着重要作用,下列说法错误的是( )A、双氧水可用于处理泄漏的有毒物质 B、在钢铁设备上连接金属铜保护钢铁 C、高纯硅可用于制作通信设备的芯片 D、可用核磁共振氢谱区分苯甲醇和对甲基苯酚5. 下列叙述正确的是( )A、和互称为同素异形体 B、元素周期表中位于金属与非金属分界线附近的元素属于过渡元素 C、合成氨工业中采用循环操作,主要是为了提高氮气和氢气的利用率 D、聚乳酸( )降解的产物为丙酸
6. 下列实验装置正确且能达到实验目的的是( )
)降解的产物为丙酸
6. 下列实验装置正确且能达到实验目的的是( )A
B
C
D
实验目的
实验室制乙酸乙酯
蒸干溶液制无水
苯萃取碘水中的 , 分出水层后的操作
比较碳酸与苯酚酸性强弱
实验装置



 A、A B、B C、C D、D7. 已知NA是阿伏加德罗常数的值,下列说法正确的是( )A、100g46%的乙醇水溶液含有的氧原子数为1NA B、1mol被还原为转移的电子数为6NA C、标准状况下,5.6L溴乙烷中含有分子的数目为0.25NA D、常温下,pH=2的溶液中,含有数为0.01NA8. 阿斯巴甜是一种具有清爽甜味的有机化合物,结构简式如下图所示。下列说法错误的是( )
A、A B、B C、C D、D7. 已知NA是阿伏加德罗常数的值,下列说法正确的是( )A、100g46%的乙醇水溶液含有的氧原子数为1NA B、1mol被还原为转移的电子数为6NA C、标准状况下,5.6L溴乙烷中含有分子的数目为0.25NA D、常温下,pH=2的溶液中,含有数为0.01NA8. 阿斯巴甜是一种具有清爽甜味的有机化合物,结构简式如下图所示。下列说法错误的是( ) A、存在对映异构体 B、分子式为 C、具有两性,能发生取代和氧化反应 D、1mol阿斯巴甜完全水解最多消耗4molNaOH9. 下列反应或现象的离子方程式解释正确的是( )A、过量铁粉与稀硝酸反应: B、用饱和溶液处理水垢中的: C、向溶液中滴加6mol/L的 , 溶液橙色加深: D、电解水溶液:10. 硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是( )
A、存在对映异构体 B、分子式为 C、具有两性,能发生取代和氧化反应 D、1mol阿斯巴甜完全水解最多消耗4molNaOH9. 下列反应或现象的离子方程式解释正确的是( )A、过量铁粉与稀硝酸反应: B、用饱和溶液处理水垢中的: C、向溶液中滴加6mol/L的 , 溶液橙色加深: D、电解水溶液:10. 硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是( ) A、漂白粉的有效成分是CaCl2和Ca(ClO)2 B、可用饱和NaHCO3溶液或KMnO4溶液除去CO2中的SO2气体 C、SO2氧化为SO3是可逆反应,提高O2浓度和使用适合的催化剂均可提高SO2的转化率 D、用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%11. 水浴加热滴加酚酞的溶液,颜色及pH随温度变化如下(忽略水的挥发):
A、漂白粉的有效成分是CaCl2和Ca(ClO)2 B、可用饱和NaHCO3溶液或KMnO4溶液除去CO2中的SO2气体 C、SO2氧化为SO3是可逆反应,提高O2浓度和使用适合的催化剂均可提高SO2的转化率 D、用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%11. 水浴加热滴加酚酞的溶液,颜色及pH随温度变化如下(忽略水的挥发):实验
①
②
③
④
⑤
温度/℃
20
30
40
从40℃冷却到20℃
沸水浴后冷却到20℃
颜色变化
红色略加深
红色接近①
红色比③加深较多
pH
8.31
8.29
8.26
8.31
9.20
下列说法错误的是( )
A、溶液中: B、①→③的过程中,颜色加深的原因可能是水解程度增大 C、①→③的过程中,pH稍微下降说明升温过程中减小 D、⑤比①pH增大,推测是由于分解生成的的缘故12. 下图是典型微生物燃料电池原理示意图。若用含硝酸盐废水替代图中氧气,可达到废水处理的目的(已知:a室中微生物降解有机物产生、和)。关于该电池,下列说法错误的是( ) A、a室内发生氧化反应,电极为负极 B、通过质子交换膜从a室进入b室 C、b室内发生的电极反应为: D、将硝酸盐转化为时,电极反应为:
A、a室内发生氧化反应,电极为负极 B、通过质子交换膜从a室进入b室 C、b室内发生的电极反应为: D、将硝酸盐转化为时,电极反应为:二、综合题
-
13. 铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途。回答下列问题:(1)、基态Cu原子价层电子排布式为。(2)、晶体中S原子的杂化方式为 , 的立体构型为。(3)、向溶液中加入过量氨水,可生成 , 其配体的电子式为;下列有关说法正确的是。
A.氨气极易溶于水,原因之一是分子和分子之间形成氢键
B.分子和分子空间构型不同,氨分子的键角小于水分子的键角
C.所含有的化学键有离子键、极性共价键和配位键
D.组成元素中电负性最大的是氮元素
(4)、金铜合金的一种晶体结构为立方晶型,如图所示:
①该合金的化学式为。
②已知该合金的密度为 , 阿伏加德罗常数值为NA , 则该晶胞的棱长为cm。
(5)、以情性电极电解足量的溶液。阳极上的电极反应式为: , 若该电极产生气体的物质的量为0.01mol,则析出铜的质量为g。14. 氯苯是一种重要的有机合成原料,用氯苯合成染料中间体F的两条路线如下图所示。路线1:

路线2:
 (1)、试剂a为(2)、A→B的反应类型为 , 该反应的化学方程式为。(3)、C与的相对分子质量之和比D的相对分子质量大18,该反应的化学方程式为;D→E的取代反应发生在甲氧基()的邻位,则F的结构简式为。(4)、G中所含官能团名称为。(5)、有机物I与对苯二甲酸(
(1)、试剂a为(2)、A→B的反应类型为 , 该反应的化学方程式为。(3)、C与的相对分子质量之和比D的相对分子质量大18,该反应的化学方程式为;D→E的取代反应发生在甲氧基()的邻位,则F的结构简式为。(4)、G中所含官能团名称为。(5)、有机物I与对苯二甲酸( )反应生成聚合物的结构简式为。 (6)、I与反应还可能生成的有机产物中,与F互为同分异构的是(写出结构简式)。(7)、已知:
)反应生成聚合物的结构简式为。 (6)、I与反应还可能生成的有机产物中,与F互为同分异构的是(写出结构简式)。(7)、已知: +
+
 +NaI,以苯酚和2-甲基丙烯为原料(无机试剂任选),设计制备苯叔丁醚(
+NaI,以苯酚和2-甲基丙烯为原料(无机试剂任选),设计制备苯叔丁醚( )。 15. 实验室以次氯酸盐和铁盐为原料制备少量的操作步骤如下:(1)、Ⅰ.制备NaClO强碱性饱和溶液:
)。 15. 实验室以次氯酸盐和铁盐为原料制备少量的操作步骤如下:(1)、Ⅰ.制备NaClO强碱性饱和溶液:①将20mLNaOH溶液加入仪器b中,冷水浴冷却,通入搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。

②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20gNaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
甲装置中a管的作用是。
(2)、写出甲装置中反应的化学方程式。(3)、石灰乳的作用是。(4)、反应过程中用冷水浴冷却的原因是。(5)、Ⅱ.合成①称取5.05g(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即)。
②离心分离除去水解得到的胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5min,过滤,得(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品2.13g。
合成的离子方程式为。
(6)、用异丙醇洗涤的目的是。(7)、的产率为(保留至0.1%)。16. 石油产品中含者及COS、等多种有机硫化物,石油化工催生出多种脱硫技术,请回答下列问题:(1)、已知热化学方程式:①
②
则反应
分析该反应的自发情况:。
(2)、工业生产中应用:COS的水解反应为 。某温度时,用活性作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[]的转化关系如图甲所示。
①起始向该容器中投入一定量反应物,在一定条件下,可以判断反应到达平衡状态的是(填字母)。
A.容器中气体密度不变
B.压强保持不变
C.容器中气体的平均相对分子质量保持不变
D.
②根据图甲和图乙判断该反应的最佳条件为:投料比[];温度

③P点对应的平衡常数为。(保留小数点后2位)
④当温度升高到一定值后,发现相同时间内COS(g)的水解转化率降低,猜测可能的原因是;。(写出两条)
(3)、可以用溶液吸收 , 其原理为 , 该反应的平衡常数为。(已知的 , ;的 , )