四川省自贡市2022届高三下学期第三次诊断性考试理综化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 下列有关化学与生活、生产、环保、科技等的说法正确的是( )A、北京冬奥会采用光伏发电有利于实现“碳中和” B、三星堆出土的青铜器是铜、锡、铬按一定比例熔炼而得的化合物 C、纳米级的铁粉能通过吸附作用除去水体中的Cu2+、Hg2+等重金属离子 D、我国发射的“北斗组网卫星”所使用的光导纤维是一种有机高分子材料2. NA是阿伏加德罗常数的值。下列说法错误的是( )A、18g重水(D2O)中含有的质子数为9NA B、11.2L CH4和22.4L Cl2 (均为标准状况)在光照下充分反应后的分子数为1.5 NA C、电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NA D、1 L 0.1mol·L-1的NH4Cl溶液中通入适量氨气后呈中性,此时溶液中数目为0.1 NA3. 用下列装置进行实验,仪器选择正确且能达到实验目的的是( )
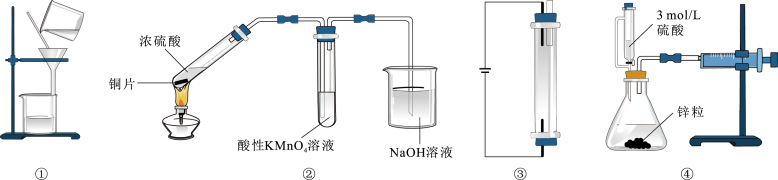 A、图①除去Fe(OH)3胶体中的Na+、Cl- B、图②可证明SO2有漂白性 C、图③用石墨作电极电解饱和食盐水生产NaClO D、图④测量生成氢气的体积4. 治疗或预防肺部纤维化的有效药物的结构简式为
A、图①除去Fe(OH)3胶体中的Na+、Cl- B、图②可证明SO2有漂白性 C、图③用石墨作电极电解饱和食盐水生产NaClO D、图④测量生成氢气的体积4. 治疗或预防肺部纤维化的有效药物的结构简式为 , 下列关于该药物的有关说法中错误的是( ) A、该有机物属于芳香族化合物,分子中有两种官能团 B、该分子中所有原子一定共平面 C、分子中苯环上的一氯代物有3种 D、1mol该分子最多能与4mol氢气完全加成5. 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是( )
, 下列关于该药物的有关说法中错误的是( ) A、该有机物属于芳香族化合物,分子中有两种官能团 B、该分子中所有原子一定共平面 C、分子中苯环上的一氯代物有3种 D、1mol该分子最多能与4mol氢气完全加成5. 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是( ) A、Y的氢化物的熔点一定低于 Z的氢化物的熔点 B、Z元素能形成多种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应水化物的稀溶液反应有黄色浑浊和无色气体产生6. 应对新冠肺炎疫情时所采取的措施是对环境进行彻底消毒,二氧化氯(ClO2 , 黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2的原理如图所示。下列说法正确的( )
A、Y的氢化物的熔点一定低于 Z的氢化物的熔点 B、Z元素能形成多种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应水化物的稀溶液反应有黄色浑浊和无色气体产生6. 应对新冠肺炎疫情时所采取的措施是对环境进行彻底消毒,二氧化氯(ClO2 , 黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2的原理如图所示。下列说法正确的( ) A、a与电源的负极连接,在b极区流出的Y溶液是浓盐酸 B、电解池a极上发生的电极反应为+ 6e -+3Cl- = NCl3+4H+ C、当有0.3 mol阴离子通过离子交换膜时,二氧化氯发生器中产生1.12 L NH3 D、二氧化氯发生器内,发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为1:67. 已知pOH=-lgc(OH-)。向20mL0.1mol·L-1的氨水中滴加未知浓度的稀H2SO4测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法错误的是( )
A、a与电源的负极连接,在b极区流出的Y溶液是浓盐酸 B、电解池a极上发生的电极反应为+ 6e -+3Cl- = NCl3+4H+ C、当有0.3 mol阴离子通过离子交换膜时,二氧化氯发生器中产生1.12 L NH3 D、二氧化氯发生器内,发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为1:67. 已知pOH=-lgc(OH-)。向20mL0.1mol·L-1的氨水中滴加未知浓度的稀H2SO4测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法错误的是( ) A、a点时溶液中存在:c(NH3·H2O)+2c(OH-)=c()+2c(H+) B、a、b、c三点对应的水解平衡常数:Kh(b)>Kh(a)>Kh(c) C、当溶液中pH=pOH时,水的电离程度最大 D、稀H2SO4的物质的量浓度为0.05mol·L-1
A、a点时溶液中存在:c(NH3·H2O)+2c(OH-)=c()+2c(H+) B、a、b、c三点对应的水解平衡常数:Kh(b)>Kh(a)>Kh(c) C、当溶液中pH=pOH时,水的电离程度最大 D、稀H2SO4的物质的量浓度为0.05mol·L-1二、综合题
-
8. 钴是一种中等活泼金属,化合价为+2价和+3价,其中CoCl2易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:(1)、甲同学用Co2O3与盐酸反应制备CoCl2•4H2O,其实验装置如下:

①烧瓶中发生反应的离子方程式为。
②由烧瓶中的溶液制取干燥的CoCl2•4H2O,还需经过的操作有蒸发浓缩、、洗涤、干燥等。
(2)、乙同学利用甲同学制得的CoCl2•4H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdCl2溶液能被CO还原为Pd。
①装置E、F是用于检验CO和CO2的,其中盛放PdCl2溶液的是装置(填“E”或“F”)。
②装置G的作用是;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是。
③通氮气的作用是。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6 , 且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为。
9. 镍、钴及其化合物在工业上有广泛的应用。以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料制备NixOy和碳酸钴(CoCO3)的工艺流程如图。
已知: Ksp[Co(OH)2]=2 ×10-15 , 请回答以下问题:
(1)、“滤渣I”主要成分是。 “ 酸浸”过程中镍的浸出率与温度和时间的关系如图所示,酸浸的最佳温度和时间是。 (2)、“氧化” 时反应的离子方程式是 , 为证明添加NaClO3已足量,可用 (写化学式)溶液进行检验。(3)、“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为。(4)、“萃取”和“反萃取”可简单表示为: 2HX + Ni2+NiX2+ 2H+。在萃取过程中加入适量氨水,其作用是 。“反萃取”需要往有机层中加(填试剂名称)(5)、若起始时c(Co2+) = 0.02 mol·L-1 , “沉钴”过程中应控制pH <7.5的原因是。10. 钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二、钼及其合金在冶金、农业、电器、化工、环保等方面有着广泛的应用。(1)、已知:
(2)、“氧化” 时反应的离子方程式是 , 为证明添加NaClO3已足量,可用 (写化学式)溶液进行检验。(3)、“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为。(4)、“萃取”和“反萃取”可简单表示为: 2HX + Ni2+NiX2+ 2H+。在萃取过程中加入适量氨水,其作用是 。“反萃取”需要往有机层中加(填试剂名称)(5)、若起始时c(Co2+) = 0.02 mol·L-1 , “沉钴”过程中应控制pH <7.5的原因是。10. 钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二、钼及其合金在冶金、农业、电器、化工、环保等方面有着广泛的应用。(1)、已知:①MoS2(s)= Mo(s) + S2(g) △H1
②S2(g) + 2O2(g)= 2SO2(g) △H2
③2MoS2 (S) + 7O2(g)=2MoO3(s) + 4SO2(g) △H3
则2Mo(s)+3O2(g) = 2MoO3(s)的△H = (用含△H1、 △H2、△H3的代数式表示)。
(2)、钼可用作NH3消除NO污染的催化剂,4NH3(g) + 6NO(g) 5N2(g)+ 6H2O (1) △H<0。①一定条件下该反应速率v正= k 正·c4(NH3)·c6(NO),v逆=k 逆·cm(N2)·cn (H2O),该反应的平衡常数K= , 则m= , n=。
②一定温度下,在体积为1L的恒容密闭容器中加入4molNH3和6moINO发生上述反应,若在相同时间内测得NH3的转化率随温度的变化曲线如图,400℃~900℃之间NH3的转化率下降由缓到急的可能原因是。
 (3)、密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是: MoS2(s)+ 4H2(g) + 2Na2CO3(s)=Mo(s)+2CO(g) + 4H2O(g) + 2Na2S(s) △H
(3)、密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是: MoS2(s)+ 4H2(g) + 2Na2CO3(s)=Mo(s)+2CO(g) + 4H2O(g) + 2Na2S(s) △H实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的△H0(填“>”或“<”); P20.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达到平衡,下列说法错误的是(选填编号)
A. v 正(H2) = v 逆(H2O)
B.再加入MoS2 , 则H2的转化率增大
C.容器内气体的密度不变时,一定达到平衡状态。
D.容器内压强不变时,一定达到平衡状态
③由图可知M点时氢气的平衡转化率为( 计算结果保留三位有效数字)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压= 气体总压×物质的量分数。图中M点的平衡常数Kp= (MPa)2。
11. 镍是一种硬而有延展性并具有铁磁性的金属,它能够高度磨光和抗腐蚀,用镍制造不锈钢和各种合金钢被广泛地用于飞机、舰艇、雷达、导弹、陶瓷颜料、永磁材料、电子遥控等领域。回答下列问题:(1)、基态Ni原子的价电子轨道表示式(电子排布图)为。(2)、具有不对称结构的Schiff碱及其与过渡金属形成的配合物结构类似于生命体系的真实情况。有一种广泛用于生命体系中金属蛋白的模拟研究,其结构如图所示。
该配合物中C原子的杂化方式为;该配合物中除H之外的组成元素的第一电离能由小到大的顺序是。
(3)、二氧化硒主要用于电解锰行业,其中一种制备方法为2NiSeO42NiSeO3+O2↑、NiSeO3NiO+SeO2。下列分子或离子的VSEPR模型为平面三角形的是____(填字母)。A、SeO B、SeO C、NiO D、SeO2(4)、草酸镍可用于制镍粉和镍的催化剂等,加热分解的化学方程式为NiC2O4NiO+CO+CO2 , 属于非极性分子的产物是 , 等物质的量的CO(C≡O)与CO2分子中的π键比为 , 与CO2互为等电子体(等电子体是指价电子数和原子数相同的分子、离子或原子团)的阴离子为(任写一种)。(5)、氢能是一种重要的二次能源,其独有的优势和丰富的资源引起人类广泛的兴趣,然而氢的储存是目前氢能利用的一大难题,现有La、Ni合金是较为理想的储氢材料,其晶胞结构如图所示:
①该储氢材料的化学式为。
②已知晶胞参数边长为anm,高为bnm,设阿伏加德罗常数的值为NA一个晶胞内可以储存18个氢原子,储氢后的晶胞密度为g·cm-3。
12. 盐酸巴氯芬(G)是一种中枢神经抑制剂,可用于脊柱损伤、脑膜炎等的治疗,其合成路线如图所示:
已知:工业上常用RaneyNi在加压下氢化还原硝基。
回答下列问题:
(1)、A→B的反应中,CH2(COOH)2的名称是。(2)、B中含氧官能团的名称是。(3)、E的结构简式为。(4)、C→D的反应方程式为。(5)、D→E的反应类型为 , 若该反应先加碱,后酸化会进行得更完全,其原因是。(6)、B有多种同分异构体,满足下列条件的B的同分异构体的结构简式为。①有两种官能团
②能发生银镜反应
③核磁共振氢谱中有三组峰,峰面积之比为3:2:2
(7)、写出由 制备
制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。