陕西省榆林市2022届高三下学期四模理科综合化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 2022年3月5日《政府工作报告》中强调要“加强废旧物资循环利用”,下列北京冬奥会的各项做法中与此无关的是( )A、实现“水立方”变为“冰立方” B、采用光伏、风能产生绿电制备绿氢 C、“冰墩墩”填充循环再生聚酯纤维 D、收集消融的雪水用于景观绿化2. 下列装置能达到实验目的的是( )
 A、利用甲装置配制一定物质的量浓度的稀硫酸 B、利用乙装置制备并收集少量二氧化氮气体 C、利用丙装置由工业酒精制取无水酒精 D、利用丁装置从氯化镁溶液中获得无水3. 分支酸是合成色氨酸和苯丙氨酸的中间体,其结构简式如图。关于分支酸的叙述正确的是( )
A、利用甲装置配制一定物质的量浓度的稀硫酸 B、利用乙装置制备并收集少量二氧化氮气体 C、利用丙装置由工业酒精制取无水酒精 D、利用丁装置从氯化镁溶液中获得无水3. 分支酸是合成色氨酸和苯丙氨酸的中间体,其结构简式如图。关于分支酸的叙述正确的是( ) A、分子中含有4种含氧官能团 B、分子中至少有8个碳原子共平面 C、分子中含有2个手性碳原子(连有4个不同原子或原子团的碳原子) D、1mol分支酸最多可与3molNaOH发生反应4. 短周期主族元素X、Y、Z、W的原子序数依次增大。元素X在常见化合物中均显负价,X、Y的最外层电子数之和与W的最外层电子数相等,Z的单质能与Y的最高价氧化物对应的水化物反应且有氢气生成。下列说法一定正确的是( )A、简单离子半径的大小顺序:W>Y>X B、Z的最高价氧化物对应的水化物是两性氢氧化物 C、X的最简单氢化物沸点高于W的最简单氢化物沸点 D、和均具有漂白性,但漂白原理不同5. 丙酮是最简单的脂肪酮,人们把它作为模型进行了大量的光化学反应研究。丙酮分子中存在如图1所示4种类型的化学键,即C=O、、、 , 丙酮在激光强度为时,在特定的时间间隔内这4种类型的化学键的键长变化如图2所示。
A、分子中含有4种含氧官能团 B、分子中至少有8个碳原子共平面 C、分子中含有2个手性碳原子(连有4个不同原子或原子团的碳原子) D、1mol分支酸最多可与3molNaOH发生反应4. 短周期主族元素X、Y、Z、W的原子序数依次增大。元素X在常见化合物中均显负价,X、Y的最外层电子数之和与W的最外层电子数相等,Z的单质能与Y的最高价氧化物对应的水化物反应且有氢气生成。下列说法一定正确的是( )A、简单离子半径的大小顺序:W>Y>X B、Z的最高价氧化物对应的水化物是两性氢氧化物 C、X的最简单氢化物沸点高于W的最简单氢化物沸点 D、和均具有漂白性,但漂白原理不同5. 丙酮是最简单的脂肪酮,人们把它作为模型进行了大量的光化学反应研究。丙酮分子中存在如图1所示4种类型的化学键,即C=O、、、 , 丙酮在激光强度为时,在特定的时间间隔内这4种类型的化学键的键长变化如图2所示。
下列判断错误的是( )
A、I表示C-C键,在该条件下最易断裂 B、丙酮在该条件下的光解反应是吸热反应 C、丙酮在该条件下解离的第一步反应可表示为 D、丙酮在该条件下的光解反应中只有化学键的断裂6. 燃烧产生的尾气中含有一定量的NO。科学家们设计了一种间接电处理法除去其中NO的装置,如下图所示,它可以将NO转化为。下列说法正确的是( ) A、a连接电源的正极 B、图中的离子交换膜应为阴离子交换膜 C、当NO吸收柱中产生1 mol 时,理论上处理的NO气体的体积为8. 96 L(标准状况) D、Pt电极B上发生的电极反应为2H2O-4e-=O2↑ +4H+7. 常温下,向10 mL0.1 mol·L-1丙烯酸(CH2=CHCOOH)溶液中滴加0.1 mol·L-1 NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。
A、a连接电源的正极 B、图中的离子交换膜应为阴离子交换膜 C、当NO吸收柱中产生1 mol 时,理论上处理的NO气体的体积为8. 96 L(标准状况) D、Pt电极B上发生的电极反应为2H2O-4e-=O2↑ +4H+7. 常温下,向10 mL0.1 mol·L-1丙烯酸(CH2=CHCOOH)溶液中滴加0.1 mol·L-1 NaOH溶液,溶液的酸度(AG)与NaOH溶液体积的关系如图所示。
已知:AG=lg , 电离度=x 100%。
若忽略溶液混合时的体积变化,下列说法正确的是( )
A、b点对应的溶液中:c( Na+) >c(CH2=CHCOO-) >c(H+) >c(OH-) B、d点对应的溶液中:c(OH-) =c(H+) +c(CH2=CHCOO-) +c( CH2=CHCOOH) C、0.1 mol·L-1 CH2=CHCOOH溶液中丙烯酸的电离度近似等于10% D、若AG=0时V=x,则丙烯酸的电离常数为Ka=×10-7二、综合题
-
8. 硫化锂(Li2S)易潮解,在加热条件下易被空气中的氧化,是一种潜在的锂电池的电解质材料。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备 , 并用制得的去还原硫酸锂制备硫化锂,反应原理: , 实验装置如图所示。请回答下列问题:
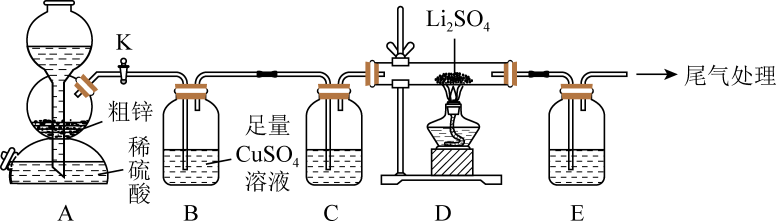 (1)、选择A装置实现随制随停,还适用于下列试剂制备对应气体的是(填标号)。
(1)、选择A装置实现随制随停,还适用于下列试剂制备对应气体的是(填标号)。a.70%硫酸、亚硫酸钠 b.:稀盐酸、大理石
c.:浓氨水、生石灰 d.:浓盐酸、
(2)、C和E装置中盛装的试剂相同,均可选择(填名称),E装置的作用是。(3)、B装置中发生反应的离子方程式为。(4)、得到的产品中往往含有一定量的杂质,某小组同学对产品中的杂质进行探究。①提出猜想:
猜想一:产品中含杂质
猜想二:产品中含杂质
猜想三:产品中含杂质S
依据所学知识,猜想三不成立,理由是。
②化学小组为验证猜想:
限选试剂:稀盐酸、稀硫酸、蒸馏水、品红溶液、双氧水、氯化钡溶液、硝酸钡溶液
实验
操作与现象
结论
I
取少量样品溶于水,
样品中不含
II
在实验I反应后的溶液中,
样品中含
(5)、测定产品纯度的方法:取wg样品加入足量稀硫酸,充分反应后,煮沸溶液,冷却后滴加酚酞溶液作指示剂,用NaOH标准溶液滴定,消耗NaOH标准溶液。①煮沸的目的是。
②样品的纯度为。
9. 一种矿物的孪生矿含有Pr2S3、FeS、SiO2等,利用该矿制取PrCl3晶体的工艺流程如下:
已知:PrCl3(aq)+2Cl-(aq)(aq) ΔH>0.
(1)、实验室用氯化铁固体配制氯化铁溶液的具体操作为。(2)、“溶浸”时Pr2S3可被FeCl3氧化,生成淡黄色的沉淀。写出Pr2S3被FeCl3氧化的离子方程式:;由于溶液酸性较强,该操作中易产生有毒气体,其化学式为 , 工业上可用(填化学式)来吸收处理。(3)、"滤渣1”的主要成分有(填化学式)。(4)、“调pH”时,可选用的试剂为____ (填标号)。A、Fe2O3 B、稀盐酸 C、Fe(OH)3 D、稀硫酸(5)、用化学平衡移动的原理解释使用冰水浴的原因:。10. 2022年北京冬奥会主火炬首次采用以氢气为燃料的微火形式,体现了绿色奥运理念。工业上,利用天然气制备氢气,还可得到乙烯、乙炔等化工产品,有关反应原理如下:反应1:
反应2:
请回答下列问题:
(1)、已知几种物质的燃烧热数据如下:物质
燃烧热
-890.3
-1299.5
-1411.0
-285.8
①能表示燃烧热的热化学方程式为。
②上述反应中,。
(2)、向恒温恒容密闭容器中充入适量 , 发生上述反应1和反应2。下列情况不能说明上述反应达到平衡状态的是____(填标号)。A、气体总压强不随时间变化 B、气体密度不随时间变化 C、气体平均摩尔质量不随时间变化 D、体积分数不随时间变化(3)、实验测得的速率方程: , (、分别为正、逆反应速率常数,只与温度、催化剂有关)。T1℃下反应达到平衡时 , T2℃下反应达到平衡时。由此推知,T1(填“>”、“<”或“=”)T2。(4)、在密闭容器中充入 , 发生上述反应1和反应2。在不同催化剂Cat1、Cat2作用下,测得单位时间内的产率与温度的关系如图1。在其他条件相同时,催化效率较高的是(填“Cat1”或“Cat2“”)。在Cat2作用下,温度高于500℃时,的产率降低的可能原因是。 (5)、一定温度下,总压强恒定为121kPa时,向密闭容器中充入由和组成的混合气体(不参与反应),同时发生反应1和反应2,测得的平衡转化率与通入气体中的物质的量分数的关系如图2。
(5)、一定温度下,总压强恒定为121kPa时,向密闭容器中充入由和组成的混合气体(不参与反应),同时发生反应1和反应2,测得的平衡转化率与通入气体中的物质的量分数的关系如图2。①图2中,随着通入气体中的物质的量分数增大,甲烷的平衡转化率降低的主要原因是。
②已知M点对应的乙炔的选择性为75%[提示:乙炔的选择性]。该温度下,反应2的平衡常数(结果保留2位有效数字)kPa。
提示:用平衡时气体分压计算的平衡常数为 , 气体分压等于气体总压×气体的物质的量分数。
11. 我国科学家最近开发的催化剂可实现NO还原制 , 为资源回收利用提供新思路。请回答下列问题:(1)、基态N原子价层电子排布图为。(2)、上述物质所含的第二周期元素中,第一电离能由大到小的顺序为(填元素符号,下同);电负性由小到大的顺序为。(3)、氨硼烷()是一种新型储氢材料。分子中B原子的杂化方式为。中的∠HNH(填“>”、“<”或“=”)中的∠HNH。(4)、已知(碳化硼),BN(氮化硼)的熔点依次为2550℃、3300℃,这两种物质的点存在差异的主要原因是。(5)、已知的晶胞结构如图1所示,该晶胞中含有的阳离子数为 , 阳离子的配位数为。 (6)、钛晶体有两种晶胞结构(如图2和图3所示)。图2中晶胞的空间利用率(φ)为(用含π的式子表示);已知图3中晶胞底边长为anm,高为cnm,NA代表阿伏加德罗常数的值,则该晶体密度为(用含a、c、NA的代数式表示)。12. 有机物G是某药物的中间体,G的一种合成路线如下:
(6)、钛晶体有两种晶胞结构(如图2和图3所示)。图2中晶胞的空间利用率(φ)为(用含π的式子表示);已知图3中晶胞底边长为anm,高为cnm,NA代表阿伏加德罗常数的值,则该晶体密度为(用含a、c、NA的代数式表示)。12. 有机物G是某药物的中间体,G的一种合成路线如下:
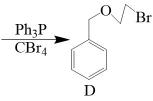




请回答下列问题:
(1)、依据官能团和碳的骨架分类,A属于;在核磁共振氢谱上G有组峰。(2)、反应A→B所需的试剂(填化学式)和条件分别为。(3)、F的分子式为 , 则F的结构简式为。F→G的反应类型是。(4)、B→C的化学方程式为。(5)、在C的同分异构体中,同时满足下列条件的结构有种(不考虑立体异构)。①分子中含有苯环;②1mol催化氧化后的产物能消耗4mol新制。
(6)、以甲苯和丙二酸二乙酯为原料合成 , 设计合成路线(无机试剂任选)。
, 设计合成路线(无机试剂任选)。