山西省大同、阳泉市2022届高三第二次模拟考试理科综合化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 2022北京冬奥会中使用了很多高新材料,如冬奥会颁奖礼服内胆使用了第二代石墨烯发热材料;速滑竞赛服使用了高性能合成纤维和聚酯材料;火炬“飞扬”使用了新型碳纤维树脂复合材料。下列有关材料的说法错误的是( )A、石墨烯、金刚石、石墨互为同素异形体 B、合成纤维与碳纤维均属于有机高分子材料 C、聚酯是由多元醇和多元酸缩聚而得的高分子聚合物 D、一般树脂材料耐火性较差,但“飞扬”的新型碳纤维树脂复合材料具有较高的耐火性2. NA为阿伏加德罗常数的值。下列说法正确的是( )A、12gl4C含有的质子数为6NA B、1molH2(g)与1molI2(g)反应生成HI(g),反应后气体分子数为2NA C、已知核反应:X+n→Y+He则10gX的中子数为10NA D、64gCu与含过量H2O2的稀硫酸反应,此过程转移的电子数为2NA3. 丙三醇无色、无臭、味甜,外观呈澄明黏稠液态,是一种有机物,俗称甘油。下列是合成甘油的一条路线:

下列说法正确的是( )
A、甘油的化学式为C3H7O3 B、丙三醇与2-丁醇互为同系物 C、环丙烷的同分异构体所有碳原子共平面 D、 转化成
转化成 消耗3molNaOH
4. 下列实验设计能达实验目的的是( )
消耗3molNaOH
4. 下列实验设计能达实验目的的是( )选项
实验目的
实验设计
A
除去CH4中的CH2=CH2
气体依次通过盛有高锰酸钾溶液、浓硫酸的洗气瓶
B
测定次氯酸钠溶液的pH
将待测液滴在湿润的pH试纸上,再与标准比色卡对照
C
探究浓度对化学反应速率的影响
取大小、形状、质量相同的Cu粒分别投入稀硝酸和浓硝酸中
D
制取H2
向稀硫酸中加入Zn和少量Cu单质
A、A B、B C、C D、D5. W、X、Z、Y为原子序数依次增大的短周期主族元素,Z与X最外层电子数之和是Y的最外层电子数的两倍,W与X可形成原子个数比为3:1的18e-分子。下列说法正确的是( )A、简单离子半径:Z>Y>W B、氢化物沸点:Z>X C、X与Z形成的化合物均可以用排空气法收集 D、Y的某种氧化物的水化物可形成二元酸6. 常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的一元酸HX溶液和HY溶液(两溶液水的电离程度:HX>HY,当Ka≤10-5时可以认为电解质达到电离平衡时的浓度近似等于起始浓度),其滴定曲线如图所示
已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是( )
A、曲线I和II对应的酸分别为HY和HX B、相比曲线I,曲线II选用酚酞作终点指示剂误差更小 C、把曲线上加入40mLNaOH溶液的点称为E点,则B1、C1和E三点溶液中由水电离出的c(H+)大小关系为C1>E>B1 D、0.01mol/L弱酸HX和HY电离度之比为1:107. 我国科学家以CO2作为无机碳源,通过熔融盐电解技术成功制备出一种核壳结构催化剂Co@C(Co@C在N极区生成),其可用于过氧单硫酸盐(PMS)活化降解邻苯二甲酸二乙酯(DEP)污染物。Co@C的熔融盐电解装置与原理图如下:
下列说法正确的是( )
A、N极反应式之一为Co3++e-=Co2+ B、Li+、Na+、K+移向M极 C、当生成22.4LO2时,转移电子数为4NA D、该装置中不存在O2-的生成二、综合题
-
8. 学习小组在实验室中设计利用铬钒废水(主要成分为Na3VO4、Na2CrO4)制备新型光催化剂钒酸铁和颜料Cr2O3的流程如下。

已知:(NH4)2S2O8具有强氧化性,不稳定易分解。
回答下列问题:
(1)、上述实验操作中无需用到的仪器或装置为____A、 B、
B、 C、
C、 D、
D、 (2)、证明滤渣FeVO4洗涤干净的方法是。(3)、写出滤液A中CrO与Na2S2O3溶液反应的离子方程式。(4)、抽滤时常用到下列装置:
(2)、证明滤渣FeVO4洗涤干净的方法是。(3)、写出滤液A中CrO与Na2S2O3溶液反应的离子方程式。(4)、抽滤时常用到下列装置:
①与普通过滤相比,抽滤的优点为。
②抽滤完毕后,应先断开之间的橡皮管。
(5)、为检测滤液B中Cr3+的浓度,学习小组取10.00mL浓缩1000倍的滤液B,酸化后加入过量(NH4)2S2O8溶液充分反应后再充分微热,冷却至室温,加入足量淀粉KI溶液,用0.010mol·L-lNa2S2O3溶液滴定(I2+2S2O→S4O+2I-)至终点,消耗Na2S2O3溶液30.00mL。①微热目的是
②滴定终点现象是
③滤液B中c(Cr3+)=
9. 四氧化三锰用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯。以工业硫酸锰为原料(含有少量CaO、MgO、Ca(OH)2等物质)制备Mn3O4的工艺流程如下:
已知:①氧化时鼓入空气使溶液的电位迅速上升;
②四氧化三锰中锰的化合价与四氧化三铁中铁的化合价类似。
回答下列问题:
(1)、为提高“溶解”效率,可采取的措施有(2)、滤渣的主要成分是(3)、氧化时,生成Mn3O4的离子方程式为(4)、向母液可加入____产生氨气以回收利用A、CaO B、稀氢氧化钠溶液 C、氢氧化钙固体 D、(NH4)2CO3(5)、通过对上述“氧化”工艺进行数据收集及资料分析可知溶液电位与pH等关系如下图所示

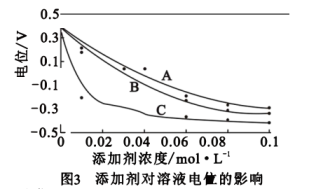
氧化时N2H4·H2O的作用是
(6)、四氧化三锰的其他制法:①热还原法
在甲烷气体存在下,将Mn2O3还原成Mn3O4的化学方程式为
②电解法:
利用电解原理,制备四氧化三锰装置如图所示。(电极材料均为惰性电极,<代表电子流向)
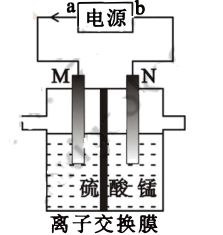
电源正极为(填“a”或“b”),阳极的电极反应式为
10. 我国中科院天津工业生物所利用光伏发电,将电解水获得的H2与CO2反应合成甲醇,再由甲醇经若干醇促反应合成淀粉,首次在实验室实现二氧化碳到淀粉的从头合成,相关论文在国际学术期刊《自然》上发表。回答下列问题:(1)、该研究成果中涉及的能量转换形式为(2)、已知:在一定温度和压强下,由最稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。某些化合物的摩尔生成焓如表所示。化合物
CO2(g)
CH3OH(g)
H2O(g)
摩尔生成焓/(kJ·mol-1)
-395
-200
-242
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
①反应Ⅰ的焓变△H1=kJ·mol-1。
②保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2 , 起始及达平衡时,容器内各气体物质的量如表所示。
CO2
H2
CH3OH
CO
H2O
起始量/mol
4.0
8.0
0
0
0
平衡量/mol
n1
3.0
已知起始时总压强为1.5pkPa,平衡时体系总压强为pkPa,则表中n1= , 反应I的平衡常数Kp=。(无需带单位,用含p的式子表示)。
(3)、取物质的量浓度为amol·L-1的甲醇,选择不同的工程酶组块作为催化剂反应10h,测得实验数据如表所示。实验序号
温度(K)
不同工程酶的组块
淀粉(g/L)
1
T1
无
0.21
2
T1
agp-M1
0.38
3
T2
agp-M2
1.82
4
T2
agp-M3
1.24
①最佳的反应条件为
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能的原因是。
③实验4可用淀粉的质量浓度表示反应速率为g·L-1·h-1 , 淀粉的产率为(用含a的代数式表示)。
11. 近年,我国科学家通过热磷化法制备出了电催化分解水的催化剂Co-Fe-P和Ni-Fe-P等过渡金属磷化物,将推动电解水制氢技术的快速发展。回答下列问题:(1)、铁元素在元素周期表中的位置 , Fe3+的价电子排布式。(2)、磷的一些卤化物的熔沸点如表所示,试解释PF3、PCl3、PBr3、PI3熔沸点逐渐升高的原因卤化磷
熔点/K
沸点/K
PF3
121.5
171.5
PCl3
161
348.5
PBr3
233
451.2
PI3
334
573
(3)、磷酸具有很强的配位能力,PO的中心原子杂化类型为 , 写出与PO互为等电子体的一种分子(4)、钴的配合物种类很多,如[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl等,[Co(NO2)(NH3)5]2+的配位数是 , 其配体中的NH3的分子空间构型为;等物质的量的[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl分别与足量的硝酸银溶液反应,两者生成氯化银的质量比为。(5)、钴蓝晶体结构如图(a)所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,求晶体的化学式为 , 密度为g·cm-3。 12. 物质G是一种抗老年痴呆药物的活性中间体。下面是物质G的一种合成路线:
12. 物质G是一种抗老年痴呆药物的活性中间体。下面是物质G的一种合成路线:
已知以下信息:
a)TBSCl为叔丁基二甲基氯硅烷,分子式(CH3)3CSi(CH3)2Cl
b)HO-(CH2)4-OHHO-CH2CH2CH2CHO
c)


回答下列问题:
(1)、A的化学名称为。B的结构简式为(2)、化合物D的分子式为 , TBSCl试剂在合成过程中的作用为(3)、物质G中含氧官能团名称为(4)、写出由B到C的化学方程式:(5)、写出物质G符合下列条件的同分异构体的结构简式①苯环上只有一种氢
②苯环上只有两种不同的取代基
③1mol该物质发生银镜反应,最多可生成6molAg
(6)、根据上述路线,设计一条以 为原料合成
为原料合成 的路线(其他试剂任选)
的路线(其他试剂任选)