山东省青岛市2021-2022学年高三下学期高考模拟检测(二)化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 中国科学家在国际上首次实现从二氧化碳到淀粉的实验室人工合成,部分核心反应如下。设表示阿伏加德罗常数的值,下列有关说法正确的是( )
 A、第一步转化属于化合反应 B、难溶于水,易溶于有机溶剂 C、3.0g与的混合物中含碳原子数为0.1 D、人工合成淀粉与植物利用光合作用合成淀粉原理相同2. 有关物质性质的说法正确的是( )A、医学上利用醛基的性质进行血糖检测 B、硝酸中插入铜片,液面上方出现红棕色气体,说明铜与硝酸生成 C、向石蕊溶液中通入氯气,溶液先变红后褪色,证明氯气具有漂白性 D、向酸性高锰酸钾溶液中通入 , 溶液褪色,证明具有漂白性3. X、Y、Z、W是处于不同周期的前四周期常见元素,原子序数依次递增。Y原子最外层电子数是周期序数的3倍,基态z原子核外s能级与p能级电子数之比为。由上述元素组成的物质转化关系如图所示,其中m、n、q为单质,其它为化合物,甲具有磁性,丙为二元强酸。下列说法错误的是( )
A、第一步转化属于化合反应 B、难溶于水,易溶于有机溶剂 C、3.0g与的混合物中含碳原子数为0.1 D、人工合成淀粉与植物利用光合作用合成淀粉原理相同2. 有关物质性质的说法正确的是( )A、医学上利用醛基的性质进行血糖检测 B、硝酸中插入铜片,液面上方出现红棕色气体,说明铜与硝酸生成 C、向石蕊溶液中通入氯气,溶液先变红后褪色,证明氯气具有漂白性 D、向酸性高锰酸钾溶液中通入 , 溶液褪色,证明具有漂白性3. X、Y、Z、W是处于不同周期的前四周期常见元素,原子序数依次递增。Y原子最外层电子数是周期序数的3倍,基态z原子核外s能级与p能级电子数之比为。由上述元素组成的物质转化关系如图所示,其中m、n、q为单质,其它为化合物,甲具有磁性,丙为二元强酸。下列说法错误的是( )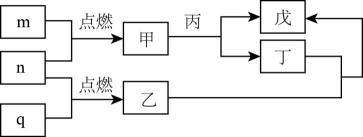 A、乙与丁反应物质的量之比为 B、乙分子构型为Ⅴ型 C、丙分子间可形成氢键 D、向戊中通入n可生成丁4. 实验室为测定镁铝合金中镁、铝含量,设计如下流程:
A、乙与丁反应物质的量之比为 B、乙分子构型为Ⅴ型 C、丙分子间可形成氢键 D、向戊中通入n可生成丁4. 实验室为测定镁铝合金中镁、铝含量,设计如下流程:
下列说法错误的是( )
A、所加盐酸体积不少于100mL B、沉淀1的质量为g C、沉淀1加足量NaOH溶液反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]- D、镁铝合金中镁、铝质量之比为5. 明星分子单三键交替纯碳原子18环的一种合成方法如图。下列分析错误的是( ) A、中C原子有和两种杂化方式 B、中存在大π键 C、和金刚石均为共价晶体 D、和均为非极性分子6. 由下列实验操作及现象所得结论或解释正确的是( )
A、中C原子有和两种杂化方式 B、中存在大π键 C、和金刚石均为共价晶体 D、和均为非极性分子6. 由下列实验操作及现象所得结论或解释正确的是( )选项
实验操作
现象
结论或解释
A
将丙烯醛滴入酸性
紫红色变浅
溶液丙烯醛中含有碳碳双键
B
常温下,测定等浓度溶液和溶液的pH
前者大于后者
得电子能力S>C
C
向固体中加入蒸馏水至固体溶解,继续加水稀释
溶液由黄绿色逐渐变为蓝色
溶液中存在平衡:
D
向5mL 溶液中加入10mL 溶液,充分反应后滴加溶液
溶液变红
与的反应是可逆反应
A、A B、B C、C D、D7. 为探究氨及铵盐性质,将晶体装入如图所示T形三通管两端,进行微型实验。下列说法错误的是( ) A、轻轻挤压任一乳胶头,若蒸馏水中有气泡冒出,则装置气密性良好 B、同时点燃两个酒精灯后,两端湿润的pH试纸均变蓝 C、实验过程中竖直支管上方会出现白烟 D、停止加热后可以交替挤压两边乳胶头,使气体更充分吸收,减少污染8. 有机物M制备利胆药物N的反应如图所示。下列说法错误的是( )
A、轻轻挤压任一乳胶头,若蒸馏水中有气泡冒出,则装置气密性良好 B、同时点燃两个酒精灯后,两端湿润的pH试纸均变蓝 C、实验过程中竖直支管上方会出现白烟 D、停止加热后可以交替挤压两边乳胶头,使气体更充分吸收,减少污染8. 有机物M制备利胆药物N的反应如图所示。下列说法错误的是( ) A、N的分子式为 B、该反应为取代反应 C、M中所有碳、氧原子可能共平面 D、N分别与足量溶液和浓溴水反应、消耗等物质的量的和9. 1-溴丙烷常用于农药、医药等合成、实验室用浓硫酸、固体、1-丙醇混合加热制备纯净的1-溴丙烷、装置如下图所示(夹持及加热装置略)。反应一段时间后,蒸馏得到粗产品,粗产品中加入适量10%溶液后分液、再加入少量固体,过滤,再次蒸馏得纯净的产品。下列说法错误的是( )
A、N的分子式为 B、该反应为取代反应 C、M中所有碳、氧原子可能共平面 D、N分别与足量溶液和浓溴水反应、消耗等物质的量的和9. 1-溴丙烷常用于农药、医药等合成、实验室用浓硫酸、固体、1-丙醇混合加热制备纯净的1-溴丙烷、装置如下图所示(夹持及加热装置略)。反应一段时间后,蒸馏得到粗产品,粗产品中加入适量10%溶液后分液、再加入少量固体,过滤,再次蒸馏得纯净的产品。下列说法错误的是( ) A、制备装置中浓硫酸用于制取并吸水提高1-丙醇转化率 B、吸收装置吸收挥发出的防止污染空气 C、分液装置中1-溴丙烷从分液漏斗下口放出 D、蒸馏装置中的冷凝管换成制备装置中的冷凝管效果更好10. 草酸亚铁晶体是生产感光材料的原料 , 制备流程如下:
A、制备装置中浓硫酸用于制取并吸水提高1-丙醇转化率 B、吸收装置吸收挥发出的防止污染空气 C、分液装置中1-溴丙烷从分液漏斗下口放出 D、蒸馏装置中的冷凝管换成制备装置中的冷凝管效果更好10. 草酸亚铁晶体是生产感光材料的原料 , 制备流程如下:下列说法错误的是( )
A、可用溶液检验是否变质 B、步骤①酸化的目的是抑制的水解 C、步骤②反应为 D、步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥11. 实验室制备硫氰酸钾的装置如图所示: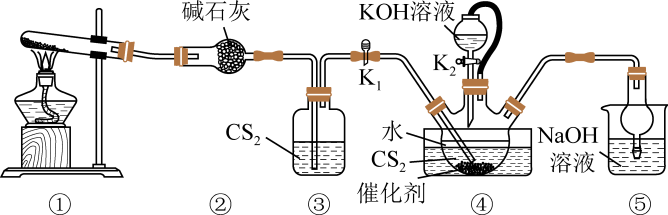
已知:;密度大于水。下列说法错误的是( )
A、根据观察③中气泡流速调控①的加热温度 B、④中长导管必须插入液面以下 C、滴加生成的反应为 D、⑤的主要作用为除去 , 防止空气污染12. 碱性溶液可脱除大气污染物 , 以作他化剂,脱除效果更好,催化过程部分物质转化如图。下列说法错误的是( ) A、过程Ⅰ和过程Ⅱ中均只作氧化剂 B、过程Ⅱ产生的活性氧原子能增强的脱除效果 C、脱除的总反应为 D、相同时,使用脱硫转化率比高
A、过程Ⅰ和过程Ⅱ中均只作氧化剂 B、过程Ⅱ产生的活性氧原子能增强的脱除效果 C、脱除的总反应为 D、相同时,使用脱硫转化率比高二、多选题
-
13. 丙烯与加成过程及能量变化如下图, 下列说法正确的是( )
 A、Ⅰ和Ⅱ为中间产物,Ⅰ比Ⅱ稳定 B、两种加成方式的决速步分别是②和④ C、生成1-溴丙烷的速率大于生成2-溴丙烷的速率 D、升高相同温度,反应③速率的增大程度大于反应①14. 有机电化学合成是目前公认的一种绿色可持续性合成策略,电化学合成1,2-二氯乙烷的装置如图。
A、Ⅰ和Ⅱ为中间产物,Ⅰ比Ⅱ稳定 B、两种加成方式的决速步分别是②和④ C、生成1-溴丙烷的速率大于生成2-溴丙烷的速率 D、升高相同温度,反应③速率的增大程度大于反应①14. 有机电化学合成是目前公认的一种绿色可持续性合成策略,电化学合成1,2-二氯乙烷的装置如图。
下列说法错误的是( )
A、a为负极,离子交换膜1为阳离子交换膜 B、M极发生反应 C、电路中每通过1mol理论上消耗28g乙烯 D、随电解进行与需及时补充15. 常温下,难溶盐的饱和溶液中随的变化关系如图所示。下列叙述正确的是(忽略第二步水解)( ) A、 B、常温下的 C、a点溶液: D、溶液时,
A、 B、常温下的 C、a点溶液: D、溶液时,三、综合题
-
16. 铀氮化合物是核燃料循环系统中的重要材料。
已知。回答下列问题:
(1)、基态氮原子价电子轨道表示式为。(2)、反应中断裂的化学键有(填标号)。a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
(3)、反应所得的气态产物中属于非极性分子的是(填化学式,下同);氢化物中更易与形成配离子的是 , 解释原因。(4)、基态U原子的外围电子排布式为 , 则处于下列状态的铀原子或离子失去一个电子所需能量最高的是____(填标号)。A、 B、 C、 D、(5)、的空间构型为 , 其结构中存在大π键,可表示为(用表示,m代表参与形成大键的原子数,n代表参与形成大键的电子数)。(6)、某种铀氮化物的晶胞如图。已知晶胞密度为 , U原子半径为 , N原子半径为 , 设为阿伏加德罗常数的值,则该晶胞的空间利用率为(用含d、、、的式子表示)。 17. 二氯化二硫是一种金黄色油状液体(沸点138℃),用作除草剂、橡胶硫化剂等。制备装置如图(夹持和加热装置略)。
17. 二氯化二硫是一种金黄色油状液体(沸点138℃),用作除草剂、橡胶硫化剂等。制备装置如图(夹持和加热装置略)。
已知:遇水发生反应;热稳定性差;能被氧化为;硫黄的熔点为113℃,沸点为445℃,
回答下列问题:
(1)、电子式为。(2)、制备的实验步骤如下:步骤1:检查装置气密性,加入硫黄,通氮气;
步骤2:一段时间后加热A中三颈烧瓶至110℃~115℃,使硫黄熔化;
步骤3:改通氯气,于115℃~125℃氯化一段时间后改通氮气;
步骤4:......;
步骤5:停止加热,持续通氮气至冷却。
①步骤1开始时需打开关闭(填“”、“”或“”)。通氮气的目的是;步骤4是。
②证明有生成的现象是。反应过程应控制的量,原因是;装置C可选择(填标号)。
 (3)、为测定产物纯度,实验操作如下:
(3)、为测定产物纯度,实验操作如下:Ⅰ.实验前称重B装置为 , 实验后称重为(均不包含冰盐水),取出产品备用,剩余产品进行后续实验;
Ⅱ.撤掉装置A、C和B中冰盐水,重新更换足量的NaOH溶液,直接连接装置B、D;
Ⅲ.打开、、 , 并不断向B中通入水蒸气、将和全部赶出;
Ⅳ.实验结束后,取下锥形瓶,滴加几滴酚酞,用盐酸标准溶液滴定剩余的溶液,消耗盐酸;
Ⅴ.不加样品,做空白对照实验,消耗盐酸。
①产品中的纯度为(写出表达式)。
②下列操作可能会导致测定结果偏高的是(填标号)。
a.水蒸气的通入时间较短
b.操作Ⅳ滴定后仰视滴定管读数
c.操作Ⅴ滴定前滴定管尖嘴处有气泡,滴定后无气泡