山东省肥城市2022届高考适应性训练(二)化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 2021年我国取得让世界瞩目的科技成果,化学功不可没,下列说法错误的是( )A、我国成功研制出多款新冠疫苗,采用冷链运输疫苗,以防止蛋白质变性 B、“海牛II号”刷新世界钻探深度,钻头采用硬质合金材料,其硬度高于组分金属 C、“天和核心舱”电推进系统中的腔体采用氮化硼陶瓷属于新型无机非金属材料 D、二氧化碳到淀粉的人工全合成技术,可减少向空气中排放CO2形成酸雨2. 下列关于物质的性质与用途不具有对应关系的是( )A、CO具有还原性,可用于冶炼铁 B、明矾溶液显酸性,可以用于清洗铜镜表面的铜锈 C、SO2具有氧化性,可用于漂白纸浆 D、NaNO3具有氧化性,可用于使铁器表面产生Fe3O43. 浓盐酸易挥发,无法直接配制具有准确浓度的标准溶液,因此配制HCl标准溶液的具体流程如下:

按上述流程进行操作,下列仪器中不需要用到的有( )
 A、1种 B、2种 C、3种 D、4种4. 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示。下列叙述正确的是( )
A、1种 B、2种 C、3种 D、4种4. 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示。下列叙述正确的是( ) A、NH3与BF3都是由极性键构成的极性分子 B、六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,立方氮化硼晶胞中含有4个氮原子、4个硼原子 C、NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1molNH4BF4含有配位键的数目为NA D、立方氮化硼和半导体材料氮化铝的结构均类似于金刚石,立方氮化硼的熔点小于氮化铝5. 实验室制备下列气体所选试剂、制备装置、收集方法及操作均正确的是( )
A、NH3与BF3都是由极性键构成的极性分子 B、六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,立方氮化硼晶胞中含有4个氮原子、4个硼原子 C、NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1molNH4BF4含有配位键的数目为NA D、立方氮化硼和半导体材料氮化铝的结构均类似于金刚石,立方氮化硼的熔点小于氮化铝5. 实验室制备下列气体所选试剂、制备装置、收集方法及操作均正确的是( )
气体
试剂
制备装置
收集方法
操作
A
O2
KMnO4
a
e
若出现倒吸现象,应立即停止加热
B
H2
Zn+稀H2SO4
b
e
试管中加入几粒胆矾可加快反应速率
C
HCl
浓硫酸+浓盐酸
b
c
试管中为浓盐酸、分液漏斗为浓硫酸
D
NH3
NH4Cl+NaOH
a
d
可用湿润的蓝色石蕊试纸验满
A、A B、B C、C D、D6. 据文献报道,氨催化还原法可用来消除某些污染气体,其反应历程如图所示:
下列说法错误的是( )
A、V的价电子排布式为3d34s2 B、V5+—OH在该反应过程中作催化剂 C、总反应化学方程式:4NH3+3O22N2+6H2O D、当消耗标准状况下11.2LO2时,整个过程转移6mole-7. 1-丁醇、溴化钠和70%的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示:
已知:
下列说法正确的是( )
A、装置I中回流的目的是为了提高产率 B、装置II中a为进水口,b为出水口 C、用装置III萃取分液时,将分层的液体依次从下放出 D、蒸馏完毕后,应先停止通冷凝水,再停止加热8. FeCl3·6H2O是城市污水及工业废水处理的高效廉价絮凝剂,具有显著的沉淀重金属及硫化物、脱色、脱臭除油、杀菌等功效。利用废料(主要成分为Fe2O3、Cu2O及少量Ga2O3)制备FeCl3·6H2O和CuSO4·5H2O的流程如下。下列说法错误的是( )已知:①镓(Ga)和铝同主族,具有相似的化学性质。
②25℃时,。
 A、浸出液1中溶质除了NaOH,还主要含有NaGeO2 B、“酸浸氧化”中H2O2参与反应的离子方程式为Cu2O+H2O2+4H+=2Cu2++3H2O C、当金属阳离子浓度为1.0×10-5mol·L-1时恰好沉淀完全,用氨水调pH后滤液3的pH为3 D、在实验室中进行“浓缩结晶”操作所需的硅酸盐仪器有酒精灯、坩埚、玻璃棒9. LDFCB是电池的一种电解质,该电解质阴离子由同周期元素原子W、X、Y、Z构成,结构如图,Y的最外层电子数等于X的核外电子总数,下列说法正确的是( )
A、浸出液1中溶质除了NaOH,还主要含有NaGeO2 B、“酸浸氧化”中H2O2参与反应的离子方程式为Cu2O+H2O2+4H+=2Cu2++3H2O C、当金属阳离子浓度为1.0×10-5mol·L-1时恰好沉淀完全,用氨水调pH后滤液3的pH为3 D、在实验室中进行“浓缩结晶”操作所需的硅酸盐仪器有酒精灯、坩埚、玻璃棒9. LDFCB是电池的一种电解质,该电解质阴离子由同周期元素原子W、X、Y、Z构成,结构如图,Y的最外层电子数等于X的核外电子总数,下列说法正确的是( ) A、同周期元素第一电离能小于Y的有5种 B、简单氢化物的还原性:X<Y C、四种元素中原子半径最大的是W D、四种元素形成的单质中Y的氧化性最强10. 某钠离子电池结构如图所示,电极A为含钠过渡金属氧化物(NaxTMO2),电极B为硬碳,充电时Na+得电子成为Na嵌入硬碳中。下列说法错误的是( )
A、同周期元素第一电离能小于Y的有5种 B、简单氢化物的还原性:X<Y C、四种元素中原子半径最大的是W D、四种元素形成的单质中Y的氧化性最强10. 某钠离子电池结构如图所示,电极A为含钠过渡金属氧化物(NaxTMO2),电极B为硬碳,充电时Na+得电子成为Na嵌入硬碳中。下列说法错误的是( ) A、充电时,电极B与外接直流电源的负极相连 B、放电时,外电路通过a mol电子时,A电极电解质损失a mol Na+ C、放电时,电极A为正极,反应可表示为Na1-xTMO2+ xNa+ + xe-= NaTMO2 D、电池总反应可表示为Na1-xTMO2+ NaxC = NaTMO2+ C11. 室温下,某溶液初始时仅溶有P和Q且浓度相等,同时发生以下两个反应:①;② , 反应①的速率可表示为 , 反应②的速率可表示为(、为速率常数)。反应体系中组分Q、X的浓度随时间变化情况如图所示(溶液体积变化忽略不计)。
A、充电时,电极B与外接直流电源的负极相连 B、放电时,外电路通过a mol电子时,A电极电解质损失a mol Na+ C、放电时,电极A为正极,反应可表示为Na1-xTMO2+ xNa+ + xe-= NaTMO2 D、电池总反应可表示为Na1-xTMO2+ NaxC = NaTMO2+ C11. 室温下,某溶液初始时仅溶有P和Q且浓度相等,同时发生以下两个反应:①;② , 反应①的速率可表示为 , 反应②的速率可表示为(、为速率常数)。反应体系中组分Q、X的浓度随时间变化情况如图所示(溶液体积变化忽略不计)。
下列说法错误的是( )
A、反应①的活化能比反应②的活化能大 B、内,Z的平均反应速率为 C、反应时, D、时Y的浓度为二、多选题
-
12. 为完成下列各组实验,所选玻璃仪器齐全、没有多余,试剂准确且操作顺序(序号代表该试剂在实验操作中出现的顺序)适当的是(不考虑存放试剂容器)( )
实验目的
玻璃仪器
试剂
A
制备Fe(OH)3胶体
烧杯、酒精灯、胶头滴管、玻璃棒
①饱和氯化铁溶液②蒸馏水
B
用银氨溶液检验葡萄糖中醛基
试管、烧杯、酒精灯、胶头滴管
①AgNO3溶液、浓氨水②葡萄糖溶液③蒸馏水
C
除去粗盐水中的Ca2+、Mg2+、
胶头滴管、试管、烧杯、漏斗、玻璃棒
①粗盐水②氯化钡溶液③碳酸钠溶液④氢氧化钠溶液⑤稀盐酸
D
制备乙酸乙酯
酒精灯、试管、导管
①乙醇②浓硫酸③乙酸④碎瓷片⑥饱和碳酸钠溶液
A、A B、B C、C D、D13. 在一定条件M可与N发生如图转化生成一种具有优良光学性能的树脂Q。下列说法正确的是( ) A、1molQ在酸性条件下的水解产物最多能消耗2molNaHCO3 B、与M官能团种类和数目都相同的芳香族化合物还有5种 C、N能发生氧化反应、还原反应、加聚反应、取代反应、消去反应 D、Q与足量的氢气完全加成后的产物中含有2个手性碳原子14. 亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下,下列说法正确的是( )
A、1molQ在酸性条件下的水解产物最多能消耗2molNaHCO3 B、与M官能团种类和数目都相同的芳香族化合物还有5种 C、N能发生氧化反应、还原反应、加聚反应、取代反应、消去反应 D、Q与足量的氢气完全加成后的产物中含有2个手性碳原子14. 亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下,下列说法正确的是( )
已知:“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。下列说法正确的是
A、NaClO2的“有效氯含量”为1.57g B、反应①中NaHSO4和ClO2的物质的量之比为1∶2 C、NaClO3氧化性强于NaClO2 D、反应②中的H2O2可以用NaClO4代替15. 向K2CO3和KHCO3的混合溶液中加入少量CaCl2 , 测得溶液中离子浓度的关系如图所示,下列说法正确的是( )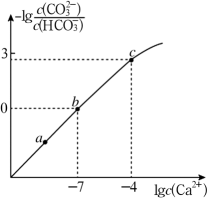 A、a、b、c三点对应的溶液中pH最大的为c点 B、该溶液中存在:< C、向b点溶液中通入CO2可使b点溶液向c点溶液转化 D、b点对应的溶液中存在:3c(Ca2+)+c(K+)+c(H+)=3c()+c(OH−)+c(Cl−)
A、a、b、c三点对应的溶液中pH最大的为c点 B、该溶液中存在:< C、向b点溶液中通入CO2可使b点溶液向c点溶液转化 D、b点对应的溶液中存在:3c(Ca2+)+c(K+)+c(H+)=3c()+c(OH−)+c(Cl−)三、综合题
-
16. 我国科学家发现AgCrS2(AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:(1)、一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用和表示,称为电子的自旋磁量子数,则基态硫原子核外最多有个电子顺时针旋转。基态铬原子自旋磁量子数的代数和为。(2)、①的电负性由大到小的顺序为(填元素符号)。
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。SeO的空间构型为 , TeO中碲原子的杂化类型是。
③H2O、H2S、H2Se、H2Te的键角依次(填“变大”、“变小”或“不变”)。
(3)、配合物[Cr(OH)3(H2O)en](en为H2NCH2CH2NH2)中(Cr与O、N均形成了配位键),H2O形成[[Cr(OH)3(H2O)en])]后,H-O-H键角将(填“变大”、“变小”或“不变”)。(4)、Cu2S呈黑色或灰黑色,已知:晶胞中S2-的位置如图1所示,Cu+位于S2-所构成的四面体中心,晶胞的侧视图如图2所示。
Cu+填充了晶胞中四面体空隙的百分率是 , S2-配位数为。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的Cu+的原子分数坐标为。若晶胞参数a nm,晶体的密度为d g·cm-3 , 则阿伏加德罗常数的值为(用含a和d的式子表示)。
17. Pd/Al2O3是常见的汽车尾气催化剂。一种从废Pd/Al2O3纳米催化剂(主要成分及含量:Pd0.3%,γ-Al2O392.8%,其他杂质6.9%)中回收金属Pd的工艺如图:
已知:γ-Al2O3能与酸反应,α-Al2O3不与酸反应。
回答下列问题:
(1)、“预处理”时,γ-Al2O3经焙烧转化为α-Al2O3 , 该操作的主要目的是。(2)、“酸浸”时,Pd转化为PdCl , 其离子方程式为。(3)、“滤液①”和“滤液②”中都含有的主要溶质有(填化学式)。(4)、“粗Pd”溶解时,可用稀HNO3替代NaClO3 , 但缺点是。两者相比,(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。(5)、“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为。(6)、酸性条件下,BrO3-能在负载Pd/Al2O3纳米催化剂的电极表面快速转化为Br-。①发生上述转化反应的电极应接电源的极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成(填化学式)。
18. 氯化氰(CNCl,熔点-6.5℃、沸点13.1℃,可溶于水并缓慢与水反应),在有机合成中有一定应用。一种实验室制取CNCl的装置如图(夹持装置已略):
回答下列问题:
(1)、若实验所需Cl2由高锰酸钾与浓盐酸反应制得,则该反应中,被氧化与未被氧化HCl的物质的量之比为(写最简比)。(2)、N2可用如图装置A制备。盛放饱和NaNO2溶液的仪器名称为;写出该反应的化学方程式:。 (3)、装置B的作用是。(4)、实验开始时先打开N2阀,通入N2的目的是;一段时间后打开Cl2阀,向装置C的三口烧瓶中缓慢通入Cl2 , 实验中必须保持温度在-10~-5℃,若高于-5℃,CNCl与NaCN反应产生NaCl和与卤素性质相似的气体(写结构式);当E中出现(填现象)时,可停止通Cl2。(5)、向盛有少量Na2S溶液的试管中通入CNCl,然后向其中滴入一滴FeCl3溶液,溶液显红色,其原因是(第一步反应用离子方程式说明)。19. 我国科学家合成了结构新颖的化合物M,为液晶的发展指明了一个新的方向。M的合成路线如下:
(3)、装置B的作用是。(4)、实验开始时先打开N2阀,通入N2的目的是;一段时间后打开Cl2阀,向装置C的三口烧瓶中缓慢通入Cl2 , 实验中必须保持温度在-10~-5℃,若高于-5℃,CNCl与NaCN反应产生NaCl和与卤素性质相似的气体(写结构式);当E中出现(填现象)时,可停止通Cl2。(5)、向盛有少量Na2S溶液的试管中通入CNCl,然后向其中滴入一滴FeCl3溶液,溶液显红色,其原因是(第一步反应用离子方程式说明)。19. 我国科学家合成了结构新颖的化合物M,为液晶的发展指明了一个新的方向。M的合成路线如下:
资料i.
 +—NH2
+—NH2 +H2O(1)、A是苯的同系物,苯环上只有一种环境的氢原子。A的名称是。(2)、D的官能团的名称是。(3)、B→D的反应类型是。(4)、J的结构简式为。(5)、下列有关K的说法正确的是(填序号)。
+H2O(1)、A是苯的同系物,苯环上只有一种环境的氢原子。A的名称是。(2)、D的官能团的名称是。(3)、B→D的反应类型是。(4)、J的结构简式为。(5)、下列有关K的说法正确的是(填序号)。a.与FeCl3溶液作用显紫色
b.含有醛基、羟基和醚键
c.存在含有苯环和碳碳双键的酯类同分异构体
(6)、K的同分异构体中,能与FeCl3溶液发生显色反应且在碱性条件下可发生水解反应的有19种(不考虑立体异构):其中核磁共振氢谱峰面积之比为2:2:2:1:1的同分异构体的结构简式为。(7)、E与K生成L的化学方程式是。(8)、依据资料i和资料ii,某小组完成了尼龙6的合成设计。资料ii.



P、Q的分子式都是C6H11ON,生成尼龙6的化学方程式是。
20. 我国科学家在“催化剂表面H2还原NO反应”的研究取得重大突破,这对消除NO的污染有重要意义。回答下列问题:(1)、N2、H2与氧气反应的能量变化如下图所示:
写出H2还原NO反应的热化学方程式。
(2)、为测定c(H2)、c(NO)与反应2NO(g)+2H2(g)N2(g)+2H2O(g)的关系,兴趣小组同学在T℃,体积为1L的密闭容器中进行实验,获得如下实验数据:实验编号
起始浓度c/(mol·L-1)
生成N2的起始反应速率V(mol·L-1·s-1)
NO
H2
a
6.00×10-3
1.00×10-3
3.18×10-3
b
6.00×10-3
2.00×10-3
6.36×10-3
c
1.00×10-3
6.00×10-3
0.53×10-3
d
3.00×10-3
6.00×10-3
4.77×10-3
①该反应的速率方程为(速率常数用k表示,不必求出k值)。
②实验d测得体系的总压强p随时间t的变化如下表所示:
t/ min
0
10
20
30
40
p/kPa
36
33.8
32
30.4
30.4
t=20min时,体系中P(H2)=kPa,v=mol·L-1·s-1(速率常数k=8.83×104mol-2· L-1· s-1 , 计算结果保留2位小数)。
(3)、研究表明,催化剂表面反应2NO(g)+2H2(g)N2(g)+2H2O(g)发生的同时还发生2NO(g)+H2(g)N2O(g)+H2O(g);反应温度、H2和NO的初始物质的量之比均对NO的有效去除率(NO转化为N2)造成较大影响。在体积均为1L的三个密闭容器中按下表所示关系加入H2和NO,在催化剂表面发生反应,实验测得不同温度时N2在NO(g)、N2O、N2三种混合气体中的平衡体积分数如图所示。甲
乙
丙
n(H2 )/( mol)
1
2
3
n(NO)/( mol)
1
1
1

①“催化剂表面H2还原NO反应”选择的合适条件是。
②在200℃,丙容器中的H2(g)和NO(g)发生反应,测得体系的平衡压强与起始压强之比为3.52:4,则NO的有效去除率为。