宁夏回族自治区中卫市2022届高三下学期第三次模拟考试理科综合化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 化学与生活、生产密切相关,下列说法错误的是( )A、蛋白质在人体内只有水解为氨基酸和甘油等小分子物质后才能被吸收 B、长征五号火箭的箭体蒙皮材料2219-铝合金,可一定程度上减轻火箭的质量 C、市面上的防晒衣通常采用聚酯纤维材料制作,不能长期用肥皂或碱性较强的液体洗涤 D、我国极力落实双碳目标:海洋生物如珊瑚的大量消亡主要因素在于CO2的浓度增大,而非温度2. 下列由实验现象所得结论错误的是( )A、向NaHSO3溶液中通入H2S,产生淡黄色沉淀,证明具有氧化性 B、常温下,向含等浓度Mg2+和Cu2+的溶液中逐滴加入NaOH溶液,先生成蓝色沉淀,则常温下,Ksp (Cu(OH)2) < Ksp (Mg(OH)2) C、向5 mL 0.2mol/L的FeCl3 溶液中加入几滴同浓度的KI溶液,再加入几滴KSCN溶液,溶液显血红色,则FeCl3与KI的反应是可逆反应 D、向NaClO溶液中滴加酚酞试剂,先变红后褪色,可以证明NaClO在溶液中发生了水解反应3. M可合成高分子材料聚醚砜,结构式如图所示,其中短周期主族元素R、X、Y、Z、W的原子序数依次增大,Y、Z位于同主族。下列说法正确的是( )
 A、简单离子结合质子能力: W<Z B、单质的沸点Y<X C、1molM 分子中含有8mol双键结构 D、把ZY2通入石蕊溶液中先变红后褪色4. 昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素的分子结构简式如图所示,关于该化合物说法错误的是( )
A、简单离子结合质子能力: W<Z B、单质的沸点Y<X C、1molM 分子中含有8mol双键结构 D、把ZY2通入石蕊溶液中先变红后褪色4. 昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素的分子结构简式如图所示,关于该化合物说法错误的是( ) A、属于烷烃 B、可发生水解反应 C、可发生加聚反应 D、具有一定的挥发性5. 图中展示的是乙烯催化氧化的过程(部分相关离子未画出),下列描述错误的是( )
A、属于烷烃 B、可发生水解反应 C、可发生加聚反应 D、具有一定的挥发性5. 图中展示的是乙烯催化氧化的过程(部分相关离子未画出),下列描述错误的是( ) A、和Cu2+在反应中都是催化剂 B、该转化过程中,有非极性键的断裂与极性键的形成 C、该转化过程中,酸性条件下过程V涉及反应为4Cu+ +O2+4H+=4Cu2++2H2O D、乙烯催化氧化的反应方程式为CH2=CH2+O2 CH3CHO+H2O6. 沉积物微生物燃料电池(SMFC)可以将沉积物中的化学能直接转化为电能,同时加速沉积物中污染物的去除,用SMFC处理含硫废水的工作原理如图所示,酸性增强不利于菌落存活。下列说法正确的是( )
A、和Cu2+在反应中都是催化剂 B、该转化过程中,有非极性键的断裂与极性键的形成 C、该转化过程中,酸性条件下过程V涉及反应为4Cu+ +O2+4H+=4Cu2++2H2O D、乙烯催化氧化的反应方程式为CH2=CH2+O2 CH3CHO+H2O6. 沉积物微生物燃料电池(SMFC)可以将沉积物中的化学能直接转化为电能,同时加速沉积物中污染物的去除,用SMFC处理含硫废水的工作原理如图所示,酸性增强不利于菌落存活。下列说法正确的是( ) A、碳棒a电势比碳棒b电势低 B、碳棒a附近释放出H+ C、碳棒b存在电极反应: S—6e—+4H2O= +8H+ D、工作一段时间后,电池效率提高7. 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液,水溶液中H2SO3、 的分布系数δ随pH的变化关系如图所示。[比如H2SO3的分布系数: δ (H2SO3)= ] ,下列有关叙述正确的( )
A、碳棒a电势比碳棒b电势低 B、碳棒a附近释放出H+ C、碳棒b存在电极反应: S—6e—+4H2O= +8H+ D、工作一段时间后,电池效率提高7. 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液,水溶液中H2SO3、 的分布系数δ随pH的变化关系如图所示。[比如H2SO3的分布系数: δ (H2SO3)= ] ,下列有关叙述正确的( ) A、当溶液pH范围为4~5时,还在继续通入SO2 B、根据曲线数据计算可知第二电离常数Ka2(H2SO3)为10—7.2 C、a点的溶液中c(H+)+ c (Na+)= c (OH— )+ c ()+c ( )+ c ()+c () D、pH=3 的溶液中,c (Na+)= c ( )+ c (H2SO3)
A、当溶液pH范围为4~5时,还在继续通入SO2 B、根据曲线数据计算可知第二电离常数Ka2(H2SO3)为10—7.2 C、a点的溶液中c(H+)+ c (Na+)= c (OH— )+ c ()+c ( )+ c ()+c () D、pH=3 的溶液中,c (Na+)= c ( )+ c (H2SO3)二、综合题
-
8. 锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6 , 还含有FeO、MgO、CaO 等杂质)为原料来制取金属锂。其中一种工艺流程如下:

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物
Fe(OH)3
Al(OH)3
Mg(OH)2
开始沉淀pH
2.7
3.7
9.6
完全沉淀pH
3.7
4.7
11
②Li2CO3在不同温度下的溶解度如下表:
温度/ ℃
0
10
20
50
75
100
Li2CO3的溶解度/g
1.539
1.406
1.329
1.181
0.866
0.728
请回答下列问题:
(1)、β-锂辉矿在处理前要粉碎,其主要目的是;用氧化物形式表示LiAlSi2O6的组成:。(2)、写出反应I中发生氧化还原反应的化学方程式:。(3)、调节pH=5的作用是除去。(4)、反应IV生成Li2CO3沉淀结束后,实验室中通常得到纯净的Li2CO3沉淀的操作名称蒸发浓缩,冷却结晶、、、干燥,为了提高所得Li2CO3沉淀的产率要使用洗涤(选填“热水”或“冷水”)。(5)、反应II加入碳酸钙,CaCO3 是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2.8 ×10-4mol/L,则生成沉淀所需原CaCl2溶液的最小浓度为 mol/L。9. 苯乙酸铜是合成优良催化剂、传感材料纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线: +H2O+H2SO4
+H2O+H2SO4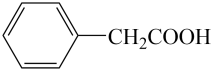 +NH4HSO4
+NH4HSO4 +Cu(OH)2
+Cu(OH)2 +H2O
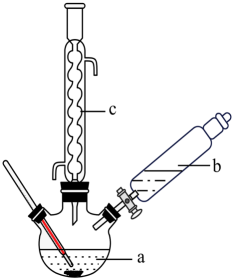
+H2O制备苯乙酸的装置示意图(加热和夹持装置等略):
已知:苯乙酸
 的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:
的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:i.在250mL三颈烧瓶a中加入70mL70%的硫酸。
ii.将a中的溶液加热至100℃,缓缓滴加40g苯乙腈(
 )到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。
)到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。iii.将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。回答下列问题:
(1)、配制70%硫酸时,加入蒸馏水与浓硫酸的先后顺序是:先加 的后加。(2)、在装置中,仪器b的名称是 ; 仪器c的作用是。反应分离苯乙酸粗品时,加适量冷水的目的是。(3)、下列仪器中可用于分离苯乙酸粗品的是____ (填标号)。A、分液漏斗 B、漏斗 C、烧杯 D、直形冷凝管 E、玻璃棒(4)、最终得到41 g苯乙酸晶体,则苯乙酸的产率是% (结果保留小数点后两位数字)(5)、写出用CuCl2·2H2O和NaOH溶液制备Cu(OH)2沉淀的化学方程式:。(6)、某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置电解CuCl2·2H2O溶液,该电池的负极反应式为。 10. 回答下列问题:(1)、已知:Fe(s)+ O2(g)= FeO(s) ΔH= -272.0KJ·mol-1
10. 回答下列问题:(1)、已知:Fe(s)+ O2(g)= FeO(s) ΔH= -272.0KJ·mol-12Al(s)+ O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1
Al和FeO发热反应的热化学方程式是。
(2)、某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断:当反应达到平衡后,其他条件不变,升高温度,反应物的转化率(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选 填序号)。
A.升高温度 B.增大反应物的浓度
C. 降低温度 D.使用催化剂
(3)、1000℃时,硫酸钠与氢气发生下列反应: Na2SO4(s)+4H2(g)= Na2S(s)+ 4H2O(g)。该反应的平衡常数表达式为K=;已知K (1000℃ ) <K (1200℃) ,若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、 “减小”或“不变”)。(4)、常温下,如果取0.1mol·L-1HA溶液与0.1mol ·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。①混合液中由水电离出的OH—浓度与0.1mol·L-1NaOH溶液中由水电离出的OH—浓度之比为;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为(填序号)>>
a.NH4Cl b. NH4A c. (NH4)2CO3
11. 铬同铁、钴、镍、铜等金属形成的合金,用于航空、宇航、电器、仪表及高端科技领域。(1)、铬的基态原子的价层电子排布式是;(2)、氯化铬酰(CrO2Cl2)的熔点为-96.5℃,沸点为117℃,固态氯化铬酰属于晶体。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl +2CrO2Cl2+3COCl2↑,COCl2分子中σ键和π键的个数比为 , 空间构型为;(3)、某镍配合物结构如图所示。
分子内含有的作用力有 (填序号),
A.氢键 B.离子键 C.金属键 D.配位键
其中属于第二周期元素的第一电能由大到小的顺序是 (填元素符号);
(4)、向CuSO4溶液中通入氨气得到深蓝色溶液的离子方程式为。(5)、CoCl3·4NH3中心原子Co3+配位数为6,向含0. 1 mol CoCl3·4NH3的溶液中滴加2mol·L-1AgNO3溶液,反应完全共消耗50 mL溶液,则CoCl3·4NH3改写成配合物的化学式为。(6)、下图是Cu的晶体一种堆积方式, 若晶胞的边长为a pm,则晶体的密度为g·cm-3(用含a和NA的表达式表示)。 12. 聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT 的一种合成路线如下图所示:
12. 聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT 的一种合成路线如下图所示:
回答下列问题:
(1)、A的结构简式是 , C 的化学名称是。(2)、⑤的反应试剂和反应条件分别是。(3)、F的分子式是 , ⑥的反应类型是。(4)、⑦的化学方程式是。(5)、M是H的同分异构体,除H外,同时符合下列条件的M的结构还有种。 (不考虑立体异构)a. 0.1 molM与足量金属钠反应生成氢气2.24 L (标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱有3组峰,且峰面积之比为3:1:1的结构简式是。