河南省开封市2022届高三下学期第三次模拟考试理科综合化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 化学科学在“国之重器”的打造中发挥着重要作用。下列有关说法错误的是( )A、“北斗系统”组网成功,北斗芯片中的半导体材料为硅 B、我国自主研发的“东方超环(人造太阳)”使用的氕、氘、氚互为同位素 C、“长征六号”运载火箭箭体采用铝合金材料,是因为材料强度高、密度大、耐腐蚀 D、“天问一号”探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料2. 2022年3月23日下午,在“四季如春”的中国空间站里,王亚平用过饱和X3Y2Z2M(结构为
 )溶液制作了一颗晶莹剔透的“冰球”,其中X、Y、Z、M是原子序数依次增大的短周期主族元素,M的原子半径是短周期主族元素中最大的。下列说法正确的是( ) A、简单离子半径:M>Z>X B、最简单氢化物的沸点:Z> Y C、X3Y2Z2M中,各原子均满足8e-稳定结构 D、X、Y形成的化合物一定不能使酸性KMnO4溶液褪色3. 己二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:
)溶液制作了一颗晶莹剔透的“冰球”,其中X、Y、Z、M是原子序数依次增大的短周期主族元素,M的原子半径是短周期主族元素中最大的。下列说法正确的是( ) A、简单离子半径:M>Z>X B、最简单氢化物的沸点:Z> Y C、X3Y2Z2M中,各原子均满足8e-稳定结构 D、X、Y形成的化合物一定不能使酸性KMnO4溶液褪色3. 己二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:
关于路线中涉及的有机物,下列说法错误的是( )
A、环己烷分子中所有碳原子不可能共平面 B、己二酸与NaHCO3溶液反应有CO2生成 C、环己醇分子中有4种不同类型的氢原子 D、苯与液溴在FeBr3作用下生成溴苯4. 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的价态-类别图。下列说法正确的是( )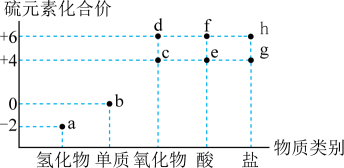 A、常温下,a和f的浓溶液反应可生成b和c B、附着有b的试管,常用酒精清洗 C、分别往d、e的溶液中滴加少量氯化钡溶液,均可产生白色沉淀 D、常温下等物质的量浓度的g、h两种钠盐溶液的pH:g<h5. 下列实验目的对应的方案设计、现象和结论都正确的是( )
A、常温下,a和f的浓溶液反应可生成b和c B、附着有b的试管,常用酒精清洗 C、分别往d、e的溶液中滴加少量氯化钡溶液,均可产生白色沉淀 D、常温下等物质的量浓度的g、h两种钠盐溶液的pH:g<h5. 下列实验目的对应的方案设计、现象和结论都正确的是( )实验目的
方案设计
现象和结论
A
探究金属钠在氧气中燃烧所得固体粉末的成分
取少量固体粉末,加入2~3mL蒸馏水
若无气体生成,则固体粉末为Na2O;若有气体生成,则固体粉末为Na2O2
B
探究FeSO4固体样品是否变质
取少量待测样品溶 于蒸馏水,滴加KSCN溶液
若溶液变为红色,说明样品已经变质;若溶液不变色,说明样品没有变质
C
比较Cl2、Br2、I2的氧化性
向KBr、KI混合溶液中依次加入少量氯水和CCl4 , 振荡,静置
溶液分层,下层呈紫红色,证明氧化性:Cl2>Br2>I2
D
比较H2CO3与CH3COOH的酸性
用pH计测定pH:
①NaHCO3 溶液
②CH3COONa溶液
pH①>②,证明H2CO3酸性弱于CH3COOH
A、A B、B C、C D、D6. 某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。下列说法正确的是( ) A、充电时,集流体B与外接电源的负极相连 B、放电时,外电路通过amol电子时,LiPON薄膜电解质损失amol Li+ C、充电时,A为阴极,电极反应式为LixSi-xe- =xLi++Si D、电池总反应可表示为LixSi+Li1-xCoO2Si+ LiCoO27. 谷氨酸[ HOOC(CH2)2CH(NH2)COOH,用H2R表示]是人体内的基本氨基酸之一,在水溶液中存在如下平衡:H2R HR-R2-。常温下,向一定浓度的H2R溶液中滴加NaOH溶液,混合溶液中lgx[x表示或]随pOH[pOH=- lgc(OH- )] 的变化如图所示。下列说法正确的是( )
A、充电时,集流体B与外接电源的负极相连 B、放电时,外电路通过amol电子时,LiPON薄膜电解质损失amol Li+ C、充电时,A为阴极,电极反应式为LixSi-xe- =xLi++Si D、电池总反应可表示为LixSi+Li1-xCoO2Si+ LiCoO27. 谷氨酸[ HOOC(CH2)2CH(NH2)COOH,用H2R表示]是人体内的基本氨基酸之一,在水溶液中存在如下平衡:H2R HR-R2-。常温下,向一定浓度的H2R溶液中滴加NaOH溶液,混合溶液中lgx[x表示或]随pOH[pOH=- lgc(OH- )] 的变化如图所示。下列说法正确的是( ) A、K1=1×10-9.7 B、pH=7时,c(HR-)>c(H2R)>c(R2-) C、曲线II表示pOH与lg的变化关系 D、M点时,c(H+ )+c(Na+ )=c(OH-)+3c(HR-)
A、K1=1×10-9.7 B、pH=7时,c(HR-)>c(H2R)>c(R2-) C、曲线II表示pOH与lg的变化关系 D、M点时,c(H+ )+c(Na+ )=c(OH-)+3c(HR-)二、综合题
-
8. 某废催化剂主要含有Al2O3(45.4%)、MoO3 (28.8%)、Fe2O3(0.7%)以及其他杂质。为节约和充分利用资源,通过如下工艺流程回收钼和铝等。

回答下列问题:
(1)、“焙烧”前要进行粉碎处理,目的是。(2)、“焙烧”中有Na2MoO4生成,发生反应的化学方程式为。(3)、钼的浸出率随碳酸钠与废催化剂的质量比、焙烧时间、浸出温度、浸出液固比变化的曲线如图所示,则最适宜的碳酸钠与废催化剂的质量比、焙烧时间、浸出温度、浸出液固比分别为、、、。 (4)、“沉铝”中,生成沉淀M的离子反应方程式为。(5)、操作A最好采用。(6)、已知金属Mo的浸出率a=()×100%,(w-浸出渣中Mo的含量;m-浸出渣的质量;z-参与浸出反应的Mo总质量),通过X-射线衍射法测定“浸出渣”中Mo的含量为0.8%,若1t废催化剂经焙烧、水浸后得到“浸出渣”0.48t,则Mo的浸出率a=。
(4)、“沉铝”中,生成沉淀M的离子反应方程式为。(5)、操作A最好采用。(6)、已知金属Mo的浸出率a=()×100%,(w-浸出渣中Mo的含量;m-浸出渣的质量;z-参与浸出反应的Mo总质量),通过X-射线衍射法测定“浸出渣”中Mo的含量为0.8%,若1t废催化剂经焙烧、水浸后得到“浸出渣”0.48t,则Mo的浸出率a=。三、综合题
-
9. 镁及其化合物是实验设计的热点载体。某学习小组设计实验,探究镁与二氧化氮反应的产物,实验装置如图所示。

已知:
①2NO2 +2NaOH=NaNO2 + NaNO3+H2O
②Mg3N2能与水反应。
回答下列问题:
(1)、仪器a的名称为;B中试剂是。(2)、实验时,先启动A中反应,当C装置中充满红棕色气体时,点燃酒精灯,这样操作的目的是。(3)、经测定,Mg与NO2反应生成MgO、Mg3N2和N2 , 其中Mg3N2和N2的物质的量相等,C中发生反应的化学方程式为。(4)、D装置的作用是。(5)、确定有氮气生成的实验现象是。(6)、实验完毕后,设计实验确认产物中有氮化镁。取少量C中残留固体于试管中,滴加蒸馏水,若则产物中有氮化镁。10. 氧化铁在工业上有广泛的应用。(1)、炼铁高炉中存在以下热化学方程式I.C(s) +CO2(g) =2CO(g) =+172.5kJ·mol-1
II.Fe2O3(s) +CO(g)2FeO(s)+CO2(g) =-3kJ·mol-1
III.FeO(s) +CO(g)Fe(s) +CO2(g) =-11kJ ·mol-1
IV.Fe2O3 (s) +3CO(g)2Fe(s)+3CO2(g)
①上述反应中,= kJ ·mol-1
②下图中能表示反应IV的平衡常数对数值(lgK)与温度的关系的是(填“I”或“II”),原因是。

③1500℃时,在某体积可变的密闭容器中,按物质的量比2:3加入Fe2O3和CO发生反应IV ,则达平衡时,Fe2O3的转化率为;下列措施能够提高Fe2O3转化率的是(填字母序号)。
a.对体系加压 b.升高反应体系的温度
c.加入适量的Na2O固体 d.增大CO在原料中的物质的量比
(2)、一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁,其反应为: Fe2O3(s)+3CH4(g)2Fe(s)+ 3CO(g) +6H2(g) ΔH >0①反应在2 L的密闭容器中进行,5 min后达到平衡,测得Fe2O3在反应中质量消耗3.2 g,则该段时间内用反应物表达的平均反应速率为mol·L-1·min-1
②该反应达到平衡时,某物理量(Y)随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”“<"或“=”)。纵坐标可以表示的物理量有填字 母序号)。
a.H2的逆反应速率 b.CH4的的体积分数
c.混合气体的平均相对分子质量 d.混合气体的密度
 11. 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:(1)、基态F原子的外围电子排布式为。(2)、N2F2(二氟氮烯)分子中,氮原子的杂化类型为sp2 , 则N2 F2的结构式为。(3)、NaHF2熔点为160℃(分解),电解可制得氟气,推测NaHF2中所含作用力的类型有。(4)、OF2主要用于火箭工程液体助燃剂,其分子的空间构型为;OF2的熔、沸点Cl2O(填“高于”或“低于”),原因是。(5)、XeF2在无机氟化物制备中有广泛的应用,其晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图中A点原子的分数坐标为( , , )。已知Xe-F键长为r pm,则B点原子的分数坐标为;晶胞中O、C间距离d=pm。
11. 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:(1)、基态F原子的外围电子排布式为。(2)、N2F2(二氟氮烯)分子中,氮原子的杂化类型为sp2 , 则N2 F2的结构式为。(3)、NaHF2熔点为160℃(分解),电解可制得氟气,推测NaHF2中所含作用力的类型有。(4)、OF2主要用于火箭工程液体助燃剂,其分子的空间构型为;OF2的熔、沸点Cl2O(填“高于”或“低于”),原因是。(5)、XeF2在无机氟化物制备中有广泛的应用,其晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图中A点原子的分数坐标为( , , )。已知Xe-F键长为r pm,则B点原子的分数坐标为;晶胞中O、C间距离d=pm。 12. G、H是中药甘草中的两种主要活性成分,其某种合成路线如下:
12. G、H是中药甘草中的两种主要活性成分,其某种合成路线如下: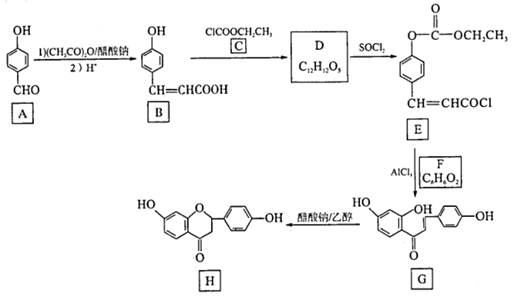
已知:RCOOHRCOCl
回答下列问题:
(1)、B中官能团名称是。(2)、D的结构简式为。(3)、E+F→G+C的化学方程式为。(4)、G生成H的反应类型是。(5)、W(C8H8O2)是A的同系物,其分子结构有种,其中核磁共振氢谱有五组峰,且峰面积比为1:1:2:2:2的结构简式为。(6)、设计以苯甲醇和(CH3CO)2O为起始原料,制备 的合成路线:。 (无机试剂任选)。
的合成路线:。 (无机试剂任选)。
-