河北省邯郸市2022届高三二模考试化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 近年来中国的航天技术发展迅速,天宫、天和、天舟、巡天、问天、梦天、天问、神舟等等体现了中国的强大科技力量,下列说法错误的是( )A、为航天器量身定制的柔性三结砷化镓太阳电池阵首次在“天和”号使用,砷化镓属于半导体 B、“天宫”空间站使用石墨烯存储器,所用材料石墨烯与金刚石互为同分异构体 C、“天问一号”火星车使用热控保温材料‑‑‑‑纳米气凝胶,可产生丁达尔效应 D、“神舟十三号”飞船返回舱外面是一层耐高温的陶瓷材料,属于无机非金属材料2. 合理正确应用化学物质会使生活更加丰富多彩。下列有关物质的性质和用途不对应的是( )
选项
物质
性质
用途
A.
ClO2
强氧化性
自来水消毒剂
B.
Fe2O3
红色
油漆中的红色颜料
C.
Na2CO3
水解显碱性
治疗胃酸的药物成分
D.
钛合金
耐高温、耐腐蚀
制做发动机的火花塞
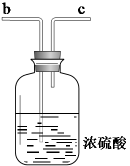
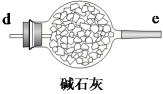
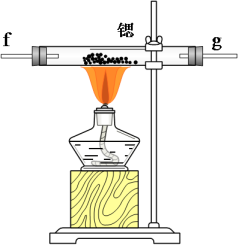
A、A B、B C、C D、D3. 硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)说法正确的是( ) A、火山口附近的单质硫燃烧时可直接生成SO3 B、硫循环中硫的化合物均为无机物 C、硫酸盐在含硫杆菌及好氧/厌氧菌作用下被还原为R1-S-R2 D、烧煤时加石灰石,可减少酸雨及温室气体的排放4. 某课外活动小组拟在加热条件下用锶与氮气反应制取氮化锶(Sr3N2),用到的装置如下图所示,下列说法中错误的是( )
A、火山口附近的单质硫燃烧时可直接生成SO3 B、硫循环中硫的化合物均为无机物 C、硫酸盐在含硫杆菌及好氧/厌氧菌作用下被还原为R1-S-R2 D、烧煤时加石灰石,可减少酸雨及温室气体的排放4. 某课外活动小组拟在加热条件下用锶与氮气反应制取氮化锶(Sr3N2),用到的装置如下图所示,下列说法中错误的是( )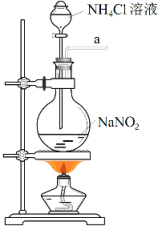
A
B
C
D
A、装置A中发生的反应的离子方程式为+N2↑+2H2O B、装置的连接顺序为a→b→c→f→g→d,碱石灰的作用是防止水蒸气进入装置D中 C、反应开始时,应先点燃A处的酒精灯,一段时间后再点燃D处的酒精灯 D、该实验装置存在的缺陷是没有尾气处理装置5. 可用于制陶瓷、药物、催化剂等,微溶于水,在冷水中溶解度较热水中大,不溶于醇。利用海水资源(主要含、 , 少量的、、、、)制备碳酸锂的一种工艺如图所示: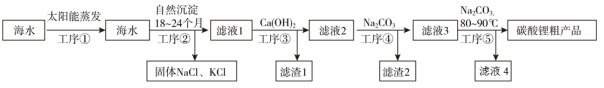
下列说法错误的是( )
A、工序③和工序④顺序可互换 B、选择温度为80~90℃,可降低碳酸锂在水中的溶解度,提高产率 C、用乙醇洗涤粗产品可起到快速干燥的效果 D、利用重结晶可分离和6. NA是阿伏加德罗常数的值。下列说法正确的是( )A、119.5gCHCl3中含有NA个Cl-H键 B、6.4gCu与足量的S反应转移的电子数为0.2NA C、1L0.1mol·L-1(NH4)2HPO4溶液中的离子总数为0.3NA D、16gCH4和36gH2O中含有的共价键数均为4NA7. 我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列关于黄芩素的说法错误的是( )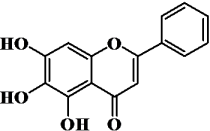 A、分子中有3种含氧官能团 B、能与NaHCO3溶液反应 C、在空气中可发生氧化反应 D、能和Br2发生取代反应和加成反应8. 据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示。下列说法错误的是( )
A、分子中有3种含氧官能团 B、能与NaHCO3溶液反应 C、在空气中可发生氧化反应 D、能和Br2发生取代反应和加成反应8. 据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示。下列说法错误的是( )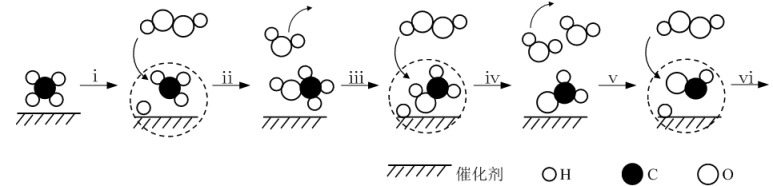 A、石墨烯为载体的催化剂的作用是破坏C-H键 B、步骤v、vi的总反应方程式是H2O2+HCHOHCOOH+H2O C、步骤ii得到的产物所有原子可能共面 D、上述反应过程中,用虚线圆框住的部分表示不稳定的自由基状态9. 《X-MOL》报道了一种两相无膜锌/吩噻嗪电池,其放电时的工作原理如图所示(在水系/非水系电解液界面上来回穿梭,维持电荷守恒)。
A、石墨烯为载体的催化剂的作用是破坏C-H键 B、步骤v、vi的总反应方程式是H2O2+HCHOHCOOH+H2O C、步骤ii得到的产物所有原子可能共面 D、上述反应过程中,用虚线圆框住的部分表示不稳定的自由基状态9. 《X-MOL》报道了一种两相无膜锌/吩噻嗪电池,其放电时的工作原理如图所示(在水系/非水系电解液界面上来回穿梭,维持电荷守恒)。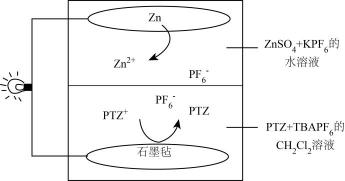
已知:的密度为 , 难溶于水。下列说法错误的是( )
A、电池使用时不能倒置 B、充电时,石墨毡上的电极反应式为 C、放电时,由层移向水层 D、放电时,Zn板每减轻6.5g,水层增重29g10. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,Z原子最外层电子数是电子层数的3倍。下列说法正确的是( )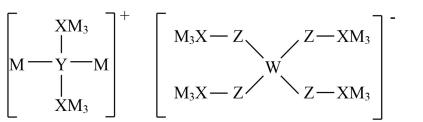 A、Z的氢化物只含极性键 B、原子半径:M>W>X>Y>Z C、Y的氢化物沸点一定比X的氢化物的沸点高 D、已知H3WO3的解离反应:H3WO3+H2O⇌H++W(OH) , Ka=5.81×10-10 , 可判断H3WO3是一元弱酸11. 某溶液中只可能含有K+、、Fe2+、Al3+、Cl-、、、中的若干种离子,离子浓度均为0.1mol·L-1.某同学进行了如下实验,下列说法正确的是( )
A、Z的氢化物只含极性键 B、原子半径:M>W>X>Y>Z C、Y的氢化物沸点一定比X的氢化物的沸点高 D、已知H3WO3的解离反应:H3WO3+H2O⇌H++W(OH) , Ka=5.81×10-10 , 可判断H3WO3是一元弱酸11. 某溶液中只可能含有K+、、Fe2+、Al3+、Cl-、、、中的若干种离子,离子浓度均为0.1mol·L-1.某同学进行了如下实验,下列说法正确的是( )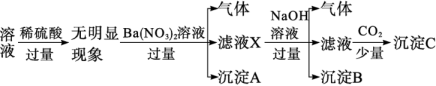 A、原溶液中含有Al3+、不含 B、原溶液中存在、Fe2+、Cl-、 C、沉淀C中含有BaCO3、Al(OH)3 D、滤液X中大量存在的阳离子有、Fe2+和Ba2+
A、原溶液中含有Al3+、不含 B、原溶液中存在、Fe2+、Cl-、 C、沉淀C中含有BaCO3、Al(OH)3 D、滤液X中大量存在的阳离子有、Fe2+和Ba2+二、多选题
-
12. 作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是( )
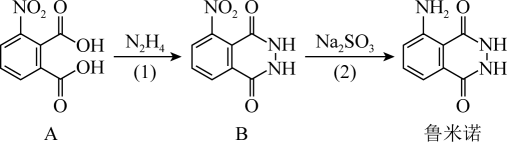 A、鲁米诺的化学式为C8H6N3O2 B、一定条件,A可以和甘油发生聚合反应 C、1molB与足量H2完全反应最多消耗5molH2 D、(1)、(2)两步的反应类型分别为取代反应和还原反应13. 25℃时,改变0.1mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( )
A、鲁米诺的化学式为C8H6N3O2 B、一定条件,A可以和甘油发生聚合反应 C、1molB与足量H2完全反应最多消耗5molH2 D、(1)、(2)两步的反应类型分别为取代反应和还原反应13. 25℃时,改变0.1mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法错误的是( )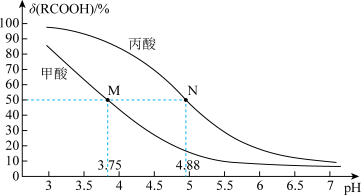 A、甲酸酸性大于丙酸 B、对于甲酸和丙酸,当lg[c(RCOOH)/c(RCOO-)]>0时,溶液都为酸性 C、等浓度的HCOONa和CH3CH2COONa两种溶液中的水电离的c(OH-)相等 D、将0.1mol·L-1的HCOOH溶液与0.1mol/L的CH3CH2COONa溶液等体积混合,所得溶液中:c(HCOO-)<c(CH3CH2COOH)
A、甲酸酸性大于丙酸 B、对于甲酸和丙酸,当lg[c(RCOOH)/c(RCOO-)]>0时,溶液都为酸性 C、等浓度的HCOONa和CH3CH2COONa两种溶液中的水电离的c(OH-)相等 D、将0.1mol·L-1的HCOOH溶液与0.1mol/L的CH3CH2COONa溶液等体积混合,所得溶液中:c(HCOO-)<c(CH3CH2COOH)三、综合题
-
14. 实验室可利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2),所用的反应装置如图所示(部分夹持装置省略),使用甲装置既可以制备氯气,也可以制备SO2气体。已知:SO2Cl2的熔点为﹣54.1℃,沸点为69.1℃,密度1.67g/mL;SO2Cl2遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。
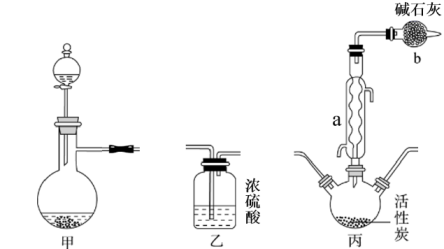 (1)、请写出该实验的仪器连接顺序:→→←←(用甲、乙、丙表示,可重复使用)。(2)、在实验前应该先对甲装置进行气密性检验,具体操作是。(3)、丙装置中仪器a的名称是 , 碱石灰的的作用。(4)、①甲装置中制备SO2时,试剂X、Y的组合最好是(填字母代号)。
(1)、请写出该实验的仪器连接顺序:→→←←(用甲、乙、丙表示,可重复使用)。(2)、在实验前应该先对甲装置进行气密性检验,具体操作是。(3)、丙装置中仪器a的名称是 , 碱石灰的的作用。(4)、①甲装置中制备SO2时,试剂X、Y的组合最好是(填字母代号)。A.98%浓硫酸+Cu B.70%H2SO4+Na2SO3固体
C.浓HNO3+Na2SO3固体 D.70%H2SO4+Na2SO3浓溶液
②甲装置中制备Cl2的化学方程式是。
(5)、SO2Cl2在潮湿的环境中对金属有强烈的腐蚀作用,结合方程式解释原因:。(6)、为测定所得产品的纯度,实验小组选用的方案是将一定体积的产品加入到足量Ba(NO3)2溶液中,过滤、洗涤、干燥,称量沉淀,然后计算含硫量,结果计算测得含硫量超过了100%,试分析造成这种结果的原因(每一步操作步骤均准确)。15. 锡酸钠晶体(Na2SnO3•3H2O)在电镀、媒染等工业应用广泛,碲(52Te)被誉为“国防与尖端技术的维生素”。以锡碲渣废料(主要成分为SnO、TeO,还含有少量Fe、Pb、As等元素的氧化物)为原料,制备锡酸钠晶体和碲的工艺流程如下图:
已知:①水碎液中溶质主要成分为Na2SnO3、Na2TeO3、Na3AsO4和Na2PbO2;
②碱性条件下,锡酸钠在水中的溶解度随温度的升高而减小。
回答下列问题:
(1)、“碱浸”时,TeO发生反应的化学方程式为。(2)、“除砷”时,若要使0.002 mol·L-1AsO沉淀完全(离子浓度不大于10-6 mol·L-1),则需要加入等体积的Ba(OH)2溶液的物质的量浓度至少为。(已知常温下Ksp[Ba3(AsO4)2]=10-24)。(3)、“除铅”时,加入Na2S所发生反应的离子方程式为。(4)、“除碲”时,相同时间内不同的反应温度对Te的脱除率的影响关系如图2,70℃后随温度升高Te的脱除率下降的原因可能是。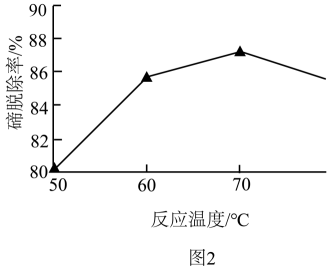 (5)、“溶析结晶”的操作是 , 洗涤,干燥,得到锡酸钠晶体。(6)、“还原”反应中还原剂与氧化剂的物质的量之比为;(7)、所得碲产品中碲的纯度测定步骤如下:
(5)、“溶析结晶”的操作是 , 洗涤,干燥,得到锡酸钠晶体。(6)、“还原”反应中还原剂与氧化剂的物质的量之比为;(7)、所得碲产品中碲的纯度测定步骤如下:①取4.0 g碲产品,加入酸使其转化为亚碲酸(H2TeO3),将其配制成100 mL溶液,取20.00 mL于锥形瓶中。
②往锥形瓶中加入20.00 mL0.1 mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。
③用0.1 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗12.00 mL硫酸亚铁铵标准溶液。
计算所得碲产品中碲的纯度为。
16. 2030年实现碳达峰,2060年达到碳中和的承诺,体现了我国的大国风范。以CO2、H2为原料合成CH3OH可有效降低空气中二氧化碳的含量,其中涉及的主要反应如下:I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.5kJ·mol-1
回答下列问题:
(1)、已知CH3OH(g)⇌CO(g)+2H2(g) ΔH3=+91kJ·mol-1 , 则ΔH1=。(2)、①不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如图所示。
压强p1、P2、P3由大到小的顺序是 , 判断理由是 , 压强为P1时,温度高于300℃后,CO2的平衡转化率升高的原因是。
②在温度为T℃下,将1mol CO2和3mol H2充入容积为5L的恒容密闭容器中。同时发生反应I和反应II,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图所示。
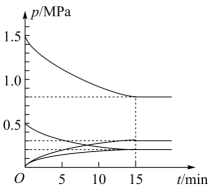
图中缺少了一种组分的分压变化,该组分是(填化学式),该组分平衡时的分压为MPa。0~15min内,反应I的反应速率v(H2)mol·L-1·min-1;T℃时,反应II的平衡常数Kp=(用分压代替浓度)。
(3)、近年来,有研究人员用CO2通过电催化生成多种燃料,实现CO2的回收利用,其工作原理如图所示。
①请写出Cu电极上产生HCOOH的电极反应式:。
②如果Cu电极上只生成0.15molC2H4和0.30molCH3OH,则Pt电极上产生O2的物质的量为mol。
17. 研究表明TiO2-aNb、Cu(In1-xGaxSe2)是光学活性物质,具有非常好的发展前景。(1)、已知铟的原子序数为49,基态铟原子的电子排布式为[Kr];Ga、In、Se,第一电离能从大到小顺序为。(2)、H2SeO3与H2SO3中酸性更强的是;原因是。(3)、31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨逸出,且又有沉淀生成,两次沉淀的物质的量之比为1∶2.则该溶液中溶质的化学式为。(4)、Cu2+与NH3形成的配离子为[Cu(NH3)4]2+ , 在该配离子中,氮氢键的键角比独立存在的气态氨分子中键角略大,其原因是。向[Cu(NH3)4]SO4溶液中加入乙醇能够析出深蓝色的晶体,试分析加入乙醇的作用:。
(5)、常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图,如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为NA。
①CuS晶体中,相邻的两个铜离子间的距离为pm。
②Cu2S晶体的密度为ρ=g·cm-3(列出计算式即可)。
(6)、近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。回答下列问题:
①图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为;
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( , , ),则原子2和3的坐标分别为、。
18. 由烯烃A制备聚合物G的合成路线如图(部分条件略去):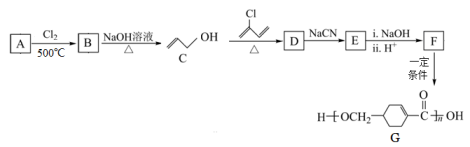
已知:
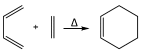 ,
, 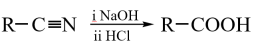 (1)、A的名称为。(2)、E的结构简式为 , F中含氧官能团名称是。(3)、A→B的反应类型为。(4)、B→C的化学方程式为。(5)、H是F的同分异构体,满足下列条件的H共有种,其中核磁共振氢谱有5组峰的结构简式是(写出一种即可)。
(1)、A的名称为。(2)、E的结构简式为 , F中含氧官能团名称是。(3)、A→B的反应类型为。(4)、B→C的化学方程式为。(5)、H是F的同分异构体,满足下列条件的H共有种,其中核磁共振氢谱有5组峰的结构简式是(写出一种即可)。①含有饱和六元碳环;②能发生水解反应;③能发生银镜反应
(6)、为了增加聚合物G的强度,可以进行硫化,其原因是。(7)、根据题目所给信息,设计以乙烯为原料制备丁二酸二乙酯的合成路线(其它无机试剂任选)。