河北省保定市2022届高三第二次模拟考试化学试题
试卷更新日期:2022-06-06 类型:高考模拟
一、单选题
-
1. 2022年全国人大政府工作报告提出:“完善节能节水、废旧物资循环利用等环保产业支持政策。”下列做法与“节能节水、废旧物资循环利用”无关的是( )A、珍爱生命、远离毒品 B、工业上用废玻璃生产酒瓶 C、用喷灌、滴灌的方法给农作物浇水 D、北京冬奥会首次采用绿氢微火主火炬2. 臭碱(主要成分是)、纯碱是两种重要的化工产品。下列说法错误的是( )A、在空气中易被氧化 B、臭碱和纯碱都属于碱 C、电解溶液时,在阴极有烧碱生成 D、热的纯碱溶液可清洗餐具表面的油污3. 下列描述的变化没有涉及电子转移的是( )A、粉骨碎身浑不怕,要留清白在人间 B、蜡烛有心还惜别,替人垂泪到天明 C、爆竹声中一岁除,春风送暖入屠苏 D、“泽中有火”“上火下泽”4. 科学家找到了大脑进入“梦乡”的钥匙——多巴胺(DA),DA的结构简式如图。下列关于DA的说法正确的是( )
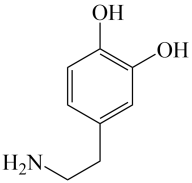 A、分子式为 B、分子中所有原子位于同一平面 C、能发生加成反应和消去反应 D、一氯代物只有3种5. 中国科学院院士张青莲教授曾主持测定的铟()等9种元素相对原子质量的新值,被采用为国际新标准。In与Al同主族。下列说法正确的是( )A、In是第四周期ⅢA族元素 B、与互为同素异形体 C、原子半径: D、碱性:6. 下列离子方程式书写正确的是( )A、氢氧化亚铁溶于稀硝酸: B、向胆矾溶液中加入少量过氧化钠: C、烧碱溶液吸收少量二氧化硫: D、在硫酸氢钠溶液中加入小钠块:7. 碘仿(CHI3)是一种外用消毒剂。某实验小组通过电解KI和丙酮(CH3COCH3)来制备碘仿。制得的粗碘仿中含少量石墨粉,分离提纯碘仿的操作中,下列仪器没有用到的是( )
A、分子式为 B、分子中所有原子位于同一平面 C、能发生加成反应和消去反应 D、一氯代物只有3种5. 中国科学院院士张青莲教授曾主持测定的铟()等9种元素相对原子质量的新值,被采用为国际新标准。In与Al同主族。下列说法正确的是( )A、In是第四周期ⅢA族元素 B、与互为同素异形体 C、原子半径: D、碱性:6. 下列离子方程式书写正确的是( )A、氢氧化亚铁溶于稀硝酸: B、向胆矾溶液中加入少量过氧化钠: C、烧碱溶液吸收少量二氧化硫: D、在硫酸氢钠溶液中加入小钠块:7. 碘仿(CHI3)是一种外用消毒剂。某实验小组通过电解KI和丙酮(CH3COCH3)来制备碘仿。制得的粗碘仿中含少量石墨粉,分离提纯碘仿的操作中,下列仪器没有用到的是( )已知几种物质的部分性质如表所示:
物质
熔点/℃
沸点/℃
溶解性
丙酮
-95
56
与水、乙醇互溶
碘仿
123
218
不溶于水,溶于热乙醇
A、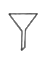 B、
B、 C、
C、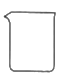 D、
D、 8. 工业上常用三种方法制氢:
8. 工业上常用三种方法制氢:⑴绿氢。电解水制氢气。(添加NaOH溶液或稀硫酸增强导电性)
⑵蓝氢。利用天然气在高温下与水蒸气反应:。
⑶灰氢。利用焦炭在高温下与水蒸气反应:。
设为阿伏加德罗常数的值。下列说法正确的是( )
A、制绿氢时,当阳极产生amol气体时,转移的电子数为2a B、制备蓝氢时,16g与足量水蒸气反应可制备的分子数为3 C、标准状况下,制备44.8L灰氢时断裂的极性键数目为 D、制备1mol时,三种制氢方法中,转移的电子数均为29. 研究人员利用膜电解技术,以溶液为主要原料制备的装置如图1所示,下列叙述正确的是( )已知:和的物质的量浓度的对数()与pH的关系如图2所示。
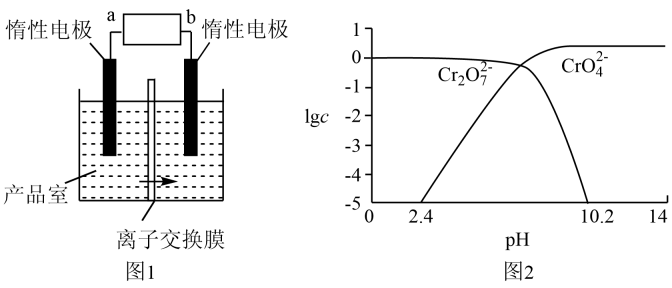 A、a为电源负极,b为正极 B、在阴极室制得 C、交换膜为阳离子交换膜 D、每转移1mol电子,产生16.8L气体10. 20世纪40年代,传统法合成己二酸工艺就已成熟,一直沿用至今。2020年我国科学家利用8种酶采用“一锅催化法”高效绿色合成了己二酸,其流程如图:
A、a为电源负极,b为正极 B、在阴极室制得 C、交换膜为阳离子交换膜 D、每转移1mol电子,产生16.8L气体10. 20世纪40年代,传统法合成己二酸工艺就已成熟,一直沿用至今。2020年我国科学家利用8种酶采用“一锅催化法”高效绿色合成了己二酸,其流程如图: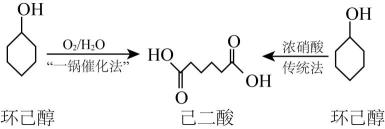
下列说法错误的是( )
A、温度越高,上述2种方法合成己二酸的速率越快 B、传统法合成己二酸会产生大气污染物,原子利用率低 C、“一锅催化法”属于绿色化学工艺 D、1mol己二酸与足量NaHCO3反应生成88gCO211. 已知:AgA、都是难溶盐。室温下,向体积均为10mL、浓度均为的NaA溶液、溶液中分别滴加的溶液,溶液中pX与溶液体积的关系如图所示[已知:或]。下列推断错误的是( )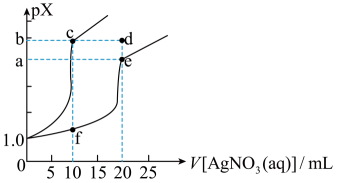 A、室温下, B、对应溶液中: C、室温下,在等量的水中,AgA溶解的物质的量更少 D、若变为 , 则c点向e点移动
A、室温下, B、对应溶液中: C、室温下,在等量的水中,AgA溶解的物质的量更少 D、若变为 , 则c点向e点移动二、多选题
-
12. 工业上用接触法制备浓硫酸的原理如下:
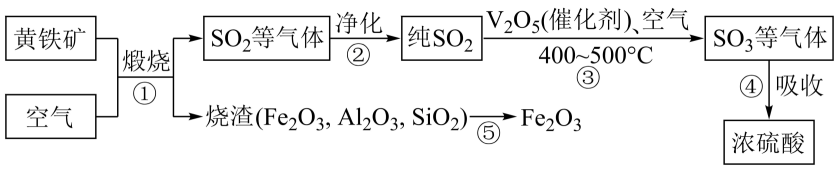
已知:
下列说法错误的是( )
A、增大反应容器的体积可以提高煅烧速率 B、步骤④中产生的尾气经净化后循环利用可以提高原料利用率 C、温度越高,越有利于SO2的催化氧化反应 D、步骤③中充入适当过量的空气能提高SO2的转化率13. 短周期主族元素W、X、Y、Z的原子序数依次增大,且位于同一周期,W、X的核电荷数之和等于Z的核外电子总数,由这四种元素组成的化合物(M)的结构如图所示。下列推断错误的是( )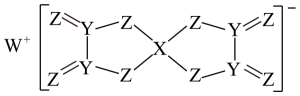 A、原子半径:W>X>Y>Z B、最简单氢化物的稳定性:Z>Y C、熔点:W2Z<YZ D、M中所有原子均达到8电子结构
A、原子半径:W>X>Y>Z B、最简单氢化物的稳定性:Z>Y C、熔点:W2Z<YZ D、M中所有原子均达到8电子结构三、综合题
-
14. 硫化锌(ZnS)是一种半导体材料,某小组在实验室制备硫化锌:。回答下列问题:
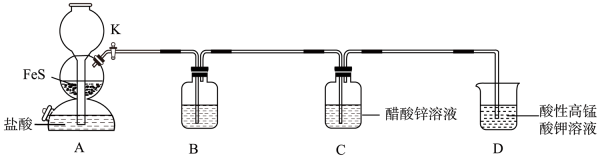 (1)、装置A中发生反应的化学方程式为。(2)、装置B中盛装的试剂可能是(填标号)。
(1)、装置A中发生反应的化学方程式为。(2)、装置B中盛装的试剂可能是(填标号)。a.NaOH溶液 b.饱和NaHS溶液 c.新制氯水
(3)、装置A能控制反应的发生和停止,装置C中完全反应后,停止装置A中反应的操作是。(4)、当装置D中0.01mol完全反应时,转移0.08mol电子,则该反应中氧化产物与还原产物的物质的量之比为。(5)、实验完毕后,从装置C中得到较纯净的ZnS的操作是(填标号)、洗涤、干燥。 (6)、测定ZnS产品纯度。
(6)、测定ZnS产品纯度。准确称取mg产品(杂质不含Zn元素)溶于足量盐酸,加热至不产生气泡,稀释成250mL溶液,准确量取25.00mL稀释后的溶液于锥形瓶中,调节pH在1.5~3,用二苯胺作指示剂,用的亚铁氰化钾{}标准溶液滴定至终点,消耗标准溶液VmL。
已知:滴定反应为。
①加热的目的是。
②该产品中ZnS的质量分数为(用含m、c、V的代数式表示)%。
③如果其他操作均正确,滴定前俯视读数,滴定终点时仰视读数,那么测得结果(填“偏高”、“偏低”或“无影响”)。
15. 铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2 , 还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题: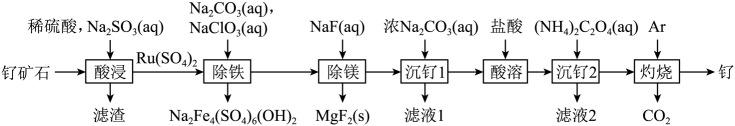 (1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。
(1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。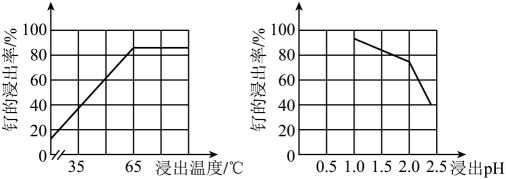 (3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)16. 我国科学家利用钴分子筛实现丙烯高选择性合成甲基环氧乙烷():
(3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)16. 我国科学家利用钴分子筛实现丙烯高选择性合成甲基环氧乙烷():主反应:(g,甲基环氧乙烷)
副反应:(g,丙醛) (a、b都大于0)
请回答下列问题:
(1)、(g,甲基环氧乙烷)(g,丙醛) 。(2)、一定温度下,在恒容密闭容器中充入和 , 同时发生上述两个反应,下列表明反应已达到平衡状态的是____(填标号)。A、混合气体的密度不随时间变化 B、混合气体的总压强不随时间变化 C、混合气体的平均摩尔质量不随时间变化 D、消耗丙烯的速率等于消耗O2速率的2倍(3)、在恒容密闭容器中充人一定量丙烯和氧气,在不同催化剂Cat1、Cat2条件下发生反应(g,甲基环氧乙烷),测得单位时间内丙烯转化率与温度的关系如图1。①相对催化效率较大的催化剂是(填“Cat1”或“Cat2”)。
②在Cat1催化下,300℃时对应的状态(填“是”或“不是”)平衡状态,判断的依据是。
③在Cat1催化下,温度高于300℃时丙烯转化率急剧下降的主要原因可能是。(答一条即可)
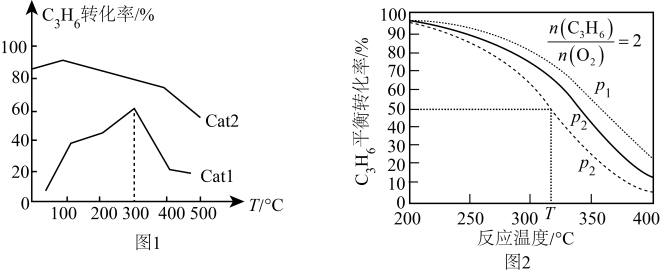 (4)、在一密闭容器中充入2mol丙烯和xmol , 同时发生上述两个反应,测得丙烯平衡转化率与温度、压强的关系如图2。
(4)、在一密闭容器中充入2mol丙烯和xmol , 同时发生上述两个反应,测得丙烯平衡转化率与温度、压强的关系如图2。①其他条件相同,p1、p2、p3由大到小的顺序为。
②在p3、T℃时反应达到平衡,甲基环氧乙烷选择性为80%,此时容器体积为2L。
提示:甲基环氧乙烷选择性等于甲基环氧乙烷的物质的量与甲基环氧乙烷和丙醛总物质的量之比。
主反应的平衡常数K=。保持温度、容积不变,再充入0.5mol和0.5mol , 副反应(填“向正反应方向”、“向逆反应方向”或“不”)进行。
17. 我国科学家构建了新型催化剂“纳米片”(Co-N-C),该“纳米片“可用于氧化SO和吸附Hg2+。回答下列问题:(1)、基态Co原子的价层电子排布式为 , N、C、Co中第一电离能最大的是(填元素符号)。(2)、在空气中SO会被氧化成SO。SO的空间构型是 , SO中S原子采用杂化。(3)、[Co(NH3)4(H2O)Cl]Cl2是钴的一种配合物,含1mol[Co(NH3)4(H2O)Cl]Cl2的溶液与足量AgNO3溶液能生成molAgCl,[Co(NH3)4(H2O)Cl]Cl2中Co2+的配位数为。(4)、氰气[(CN)2]称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则(CN)2分子中σ键、π键个数之比为。(5)、氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如图1所示。它的化学式为 , 它的硬度超过金刚石的主要原因是。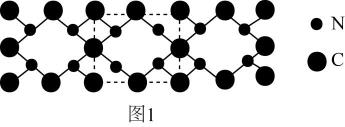 (6)、氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( , , ),则原子3的原子分数坐标为。若氮化馆的晶体密度为ρg·cm-3 , 则晶胞中Ga-N键的键长为(用含ρ、NA的代数式表示)pm。已知NA为阿伏加德罗常数的值。
(6)、氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( , , ),则原子3的原子分数坐标为。若氮化馆的晶体密度为ρg·cm-3 , 则晶胞中Ga-N键的键长为(用含ρ、NA的代数式表示)pm。已知NA为阿伏加德罗常数的值。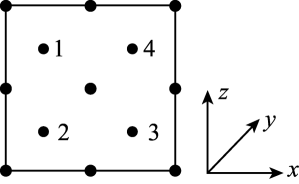
图2
18. 以芳香族化合物A为原料制备某药物中间体G的路线如图: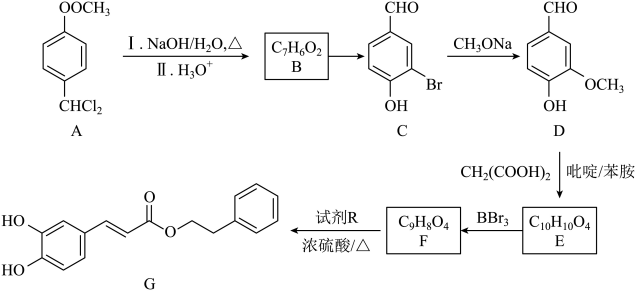
已知:①同一碳原子上连两个羟基时不稳定,易发生反应:RCH(OH)2→RCHO+H2O。
②R1CHO+R2CH2COOHR1CH=CHR2+CO2↑+H2O。
③
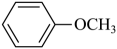
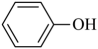
请回答下列问题:
(1)、G中含氧官能团的名称为。(2)、C→D的反应类型是 , C的分子式为。(3)、E的结构简式为。(4)、F→G的化学方程式为。(5)、H是D的同分异构体,同时满足下列条件的H有种(不包括立体异构)。①遇氯化铁溶液发生显色反应;
②能发生水解反应;
③苯环上只有两个取代基。
其中,核磁共振氢谱显示4组峰,且峰的面积之比为3:2:2:1的结构简式为(写一种即可)。
(6)、根据上述路线中的相关知识,设计以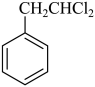 和乙酸为原料制备
和乙酸为原料制备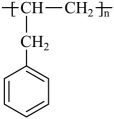 的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)